选项 | A | B | C | D |
生活中的物质 | 钡餐 | 铁红 | 小苏打 | 漂白液 |
有效成分化学式 | ||||
用途 | X射线造影剂 | 作颜料 | 做发酵粉 | 作消毒剂 |
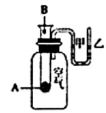
实验编号 | 水果种类 | 电极间距离/cm | 电流/μA |
1 | 番茄 | 1 | 98.7 |
2 | 番茄 | 2 | 72.5 |
3 | 苹果 | 2 | 27.2 |
电池工作时,下列说法不正确的是( )

| W |
| X |
|
Q | Y | Z |
 B .
B . 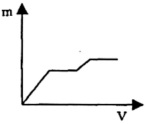 C .
C . 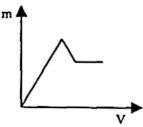 D .
D . 

阳离子 |
|
阴离子 |
|
| 实验目的 | 实验操作 | 现象及结论 |
A | 比较 | 取少量 | 溶液由浅绿色变为黄色氧化性: |
B | 比较Mg与Al金属性强弱 | 向同浓度等体积的 |
|
C | 检验 | 向溶液中滴加酸性 | 若紫红色退去,则溶液中含有 |
D | 检验溶液中是否含有 | 取少量溶液于试管中,滴加稀盐酸 | 若产生的气体能使澄清石灰水变浑浊,则溶液中含有 |
步聚1:取1粒药片(每片药片的质量为0.50g)研碎
步聚2:将上研碎的药片粉末加入到40.00mL0.40mol/L稀盐酸中溶解
步聚3:用0.40mol/LNaOH溶液中和过量稀盐酸,记录消耗NaOH溶液的体积;
请回答下列问题。
测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
V[NaOH(aq)]/mL | 16.04 | 15.96 | 16.20 | 16.00 |
根据这个同学的实验数据,计算这种药片中氢氧化铝的质量分数为%(结果保留小数点后两位)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
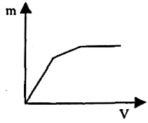
①量取50.00mL甲溶液,向其中缓慢滴加乙溶液20.00mL,共收集到二氧化碳气体560mL。
②另取20.00mL乙溶液,向其中缓慢滴加甲溶液50.00mL,共收集到二氧化碳气体224mL。上述气体体积均已换算为标准状况,则根据上述操述及实验数据填空:乙是,甲溶液的物质的量浓度为,乙溶液的物质的量浓度为;(二氧化碳在溶液中的少量溶解忽略不计)