 B . 圆底烧瓶
B . 圆底烧瓶 D . 坩埚
D . 坩埚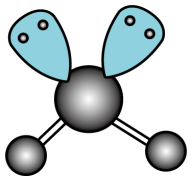 D . 氧化钠的电子式:
D . 氧化钠的电子式: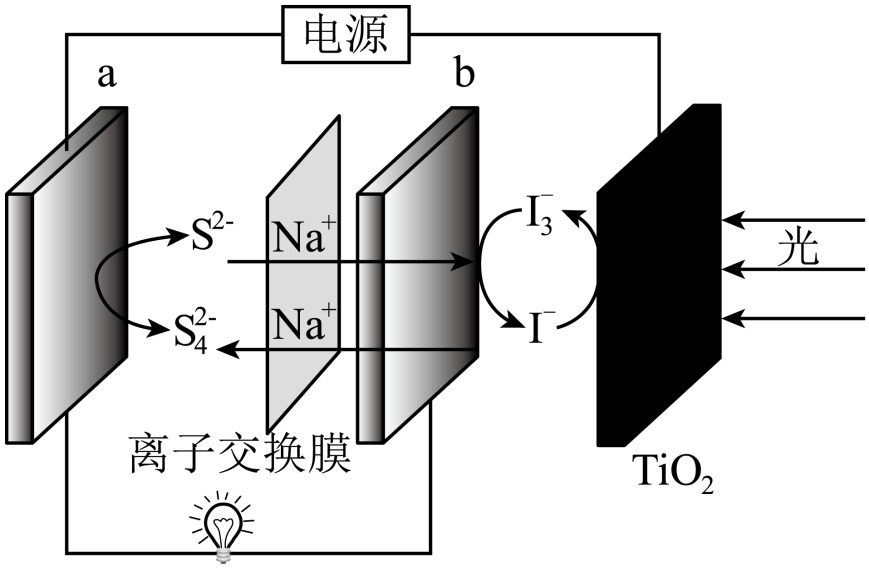


| 探究方案 | 探究目的 |
A | 分别向 | 探究反应物浓度对化学反应速率的影响 |
B | 分别向浓度均为 | 比较 |
C | 分别测浓度均为 | 比较 |
D | 向 |
|
①氨硼烷中N为价,B为+3价。H、B、N的电负性由大到小依次为。
②氨硼烷在催化剂作用下水解释放氢气 ,
的结构如图1所示,在该反应中,B原子的杂化轨道类型由变为。
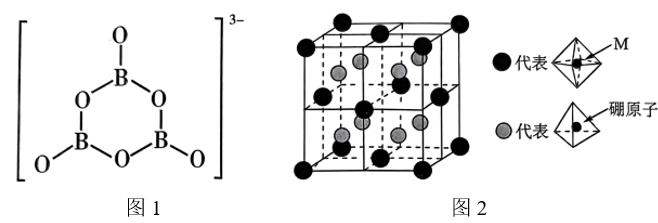
③Crabtree等报道了26种分子间存在双氢键X-H…H-Y(即H与H之间形成类氢键)。已知氨硼烷分子间也存在“双氢键”使氨硼烷的熔点明显升高,请分析“双氢键”能形成的原因是。
①键②
键③氢键④配位键⑤离子键
①
②
③
计算热分解反应④
的
kJ/mol,该反应在(填“高温”或“低温”)条件下才可自发进行。
①相比克劳斯工艺,利用反应④高温热分解方法的优缺点是。
②研究人员对反应条件对产率的影响进行了如图研究。同条件下,相同时间内,
产率随温度的变化如图1所示。由图1可见,随着温度升高,
产率先增大后减小,原因是。
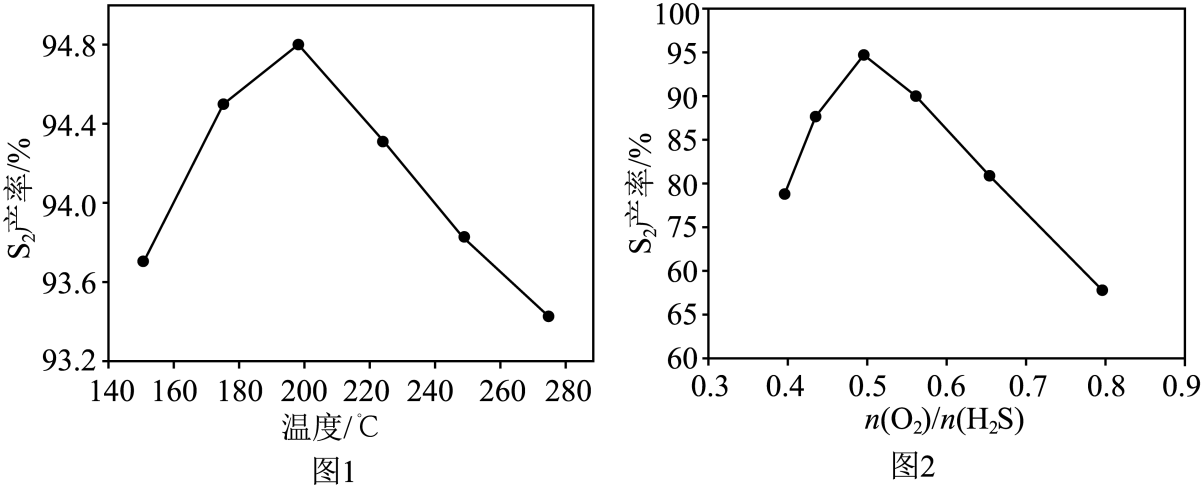
③相同条件下,相同时间内,产率随
值的变化如图2所示。
值过高不利于提高
产率,可能的原因是。
I.制备的途径如下,请回答下列问题:
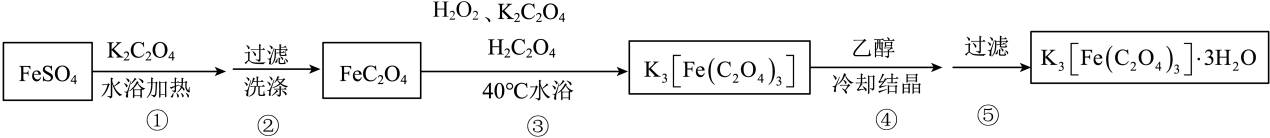
研究小组通过查阅资料得知:
a.对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如、
)难溶于水,但能溶解于稀硝酸。
请回答:
步骤1:称取5.000g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取25.00mL溶液,用酸性
溶液滴定至终点,消耗12.30mL。
步骤3:另取25.00mL溶液,加入过量Zn粉,将还原成
, 过滤,洗涤,将滤液和洗涤液合并。
步骤4:用酸性
溶液滴定合并后溶液至终点,测得实验数据:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 14.90 |
2 | 0.52 | 14.82 |
3 | 0.00 | 16.66 |
4 | 0.30 | 14.10 |
步骤1中所需玻璃仪器除烧杯、玻璃棒、量筒外还有(填仪器名称)。

已知常温下: ,
。
回答下列问题: