|
|
|
|
A.量取25.00 mL待测液 | B.除去碱式滴定管中的气泡 | C.滴定时,眼睛注视锥形瓶内溶液颜色的变化 | D.滴定结束时读数 |
元素 | 相关信息 |
V | 核外电子数与周期序数相等 |
W | 成对电子数与未成对电子数之比为3∶1 |
X | 在火山口附近可发现其淡黄色固体单质 |
Y | 有四个电子层,且最外层电子数与最内层电子数相等 |
Z | 基态Z元素原子的价层电子排布式为 |
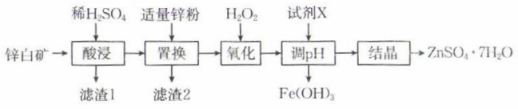
常温下,相关金属离子形成氢氧化物沉淀的pH如表所示(离子浓度小于mol⋅L
时视为沉淀完全):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
1.1 | 3.1 | |
7.6 | 9.6 | |
6.4 | 8.0 |
A.ZnO B. C.
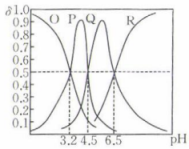
根据题中数据计算常温下的溶度积
.

①白球表示的是(填元素符号)。
②晶体的密度为g⋅cm
。