A | B | C | D |
|
|
|
|
表示相同时间内体系内 | 表示体系到达平衡后, | 装置可探究温度对该化学平衡的影响,热水中颜色变深,冷水中颜色变浅 | 表示该反应正逆反应速率随温度变化图像 |

已知:
催化剂的选择是甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测
转化率和生成
选择性[
选择性
]随温度变化的影响如图所示。下列有关说法正确的是( )

a.两烧杯夹层间碎纸条没有填满
b.配制硫酸溶液,定容时俯视
c.分多次把溶液倒入盛有硫酸的小烧杯中
d.记录混合液的最高温度作为终止温度
资料:该“碘钟实验”反应分两步进行:反应
(慢) 反应
(快)
该“碘钟实验”的总反应是。
实验序号 | 试剂体积 | 显色时间 | ||||
|
| 水 | | 淀粉溶液 | ||
① | 10 | 10 | 0 | 4 | 1 | 27.0 |
② | 5 | 10 | 5 | 4 | 1 | 54.0 |
③ | 2.5 | 10 | 4 | 1 | 108.0 | |
④ | 10 | 5 | 5 | 4 | 1 | 54.0 |
①表中。
②通过数据计算得知:,
。
Ⅰ.
Ⅱ.
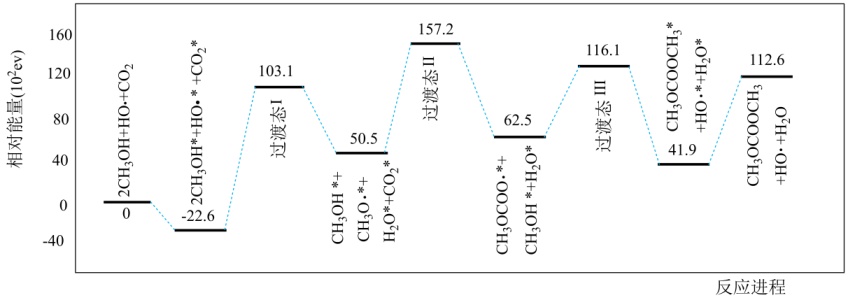
①求
②已知反应Ⅰ是整个反应的决速步,下列示意图中能体现上述反应能量变化的是(填标号)。
A.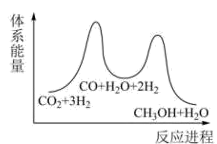
B.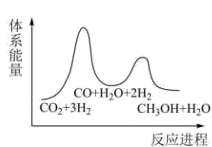
C.
D.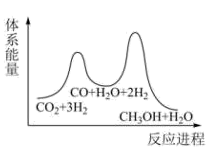
①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是(填字母)。
A.
B.相同时间内断裂的数目与断裂
数目相等
C.容器温度保持不变
D.当与
物质的量之比保持
不变
一定温度下在恒温恒容密闭容器中初始加入
和一定量
, 发生上述反应数据如下:
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
2.0 | 1.5 | 1.1 | 0.8 | 0.6 | 0.5 | 0.5 | |
3.2 |
②该温度下反应的化学平衡常数为
①温度为时,等物质的量的
和
充入体积为
的恒容密闭容器中发生反应:
。实验测得:
为速率常数。
时,
。
②温度从到
时,
, 则
时平衡压强(填“
"“
”或“
")
时平衡压强,理由是。
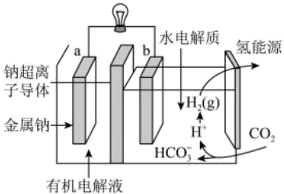
①左室有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液(填“能”或“不能”)用乙醇做溶剂。
②写出二氧化碳生成氢气的电极反应式:。

①粗铜应该为极(填“A”或“B”);
②CH3OH参加的电极方程式为;
③当A极质量变化ag,当B极质量变化bg时,左池消耗O2的质量为g;
④电解结束后,右池溶液中CuSO4的浓度会(填“增大”或“不变”或“减小”)。

①电解液中的溶质除了硫酸铜还有;
②操作a中用到的玻璃仪器除烧杯外还有;
③残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
| 反应原理 | 化学平衡常数 |
反应1 | Au+6HNO3 | K1=2×10-8 |
反应2 | Au(NO3)3+4HCl | K2=4×1011 |
反应3 | Au+3HNO3+4HCl | K3 |
请通过计算化学平衡常数来解释为什么金很难与浓硝酸反应,但却可溶于王水(浓硝酸与浓盐酸的混合物)。

①试分析点以后体系中
(Ⅲ)含量随着
大而增大的原因是。
②保持其它反应条件不变,还原体系中(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中
(Ⅲ)的最佳反应温度为

