 B .
B . 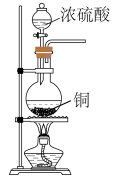 B . 检验
B . 检验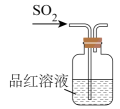 C . 干燥
C . 干燥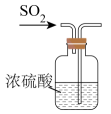 D . 收集
D . 收集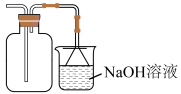
选项 | 实验目的 | 实验操作 |
A | 检验溶液中的 | 向溶液中先加盐酸,再加 |
B | 干燥 | 将气体通过盛有浓 |
C | 吸收尾气中的 | 将气体通入盛有饱和食盐水的烧杯 |
D | 测定氯水的 | 将氯水滴在 |
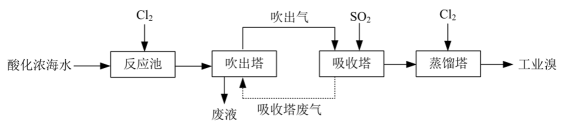
吸收塔中与
反应的离子方程式为。

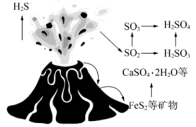
的结构式为。
与
和
溶液反应转化为
和
, 理论上转移电子的物质的量为
。
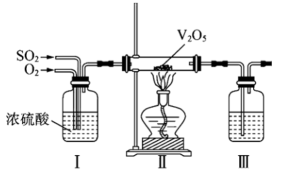
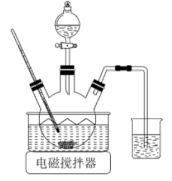
①装置I的作用是(写出两点)。
②装置III用于吸收制备硫酸,适宜的吸收剂是(填字母)。
A.溶液 B.水 C.
浓硫酸
③装置II中待反应进行后撤走酒精灯,无需持续加热,原因是。若用、水在催化剂存在时吸收尾气中的
, 吸收完成后,随着氧化的进行,溶液的
将(填“增大”“减小”或“不变”)。

写出“脱硫”时发生反应的化学方程式。