 B .
B . 

①发生还原反应的烧杯是(填“甲”或“乙”)。
②外电路的电流方向:(填“”或“
”)。
③电池工作时,盐桥中的移向(填“甲”或“乙”)烧杯。
④甲烧杯中发生的电极反应式为。

 B . 原子核外能量最高的电子云图像:
B . 原子核外能量最高的电子云图像: C . 碳
C . 碳

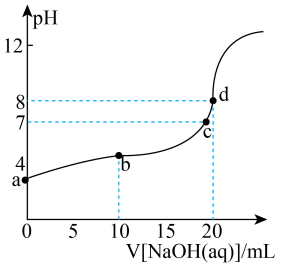
①写出水解反应的离子方程式:,往其溶液中加入下列物质,能促进
水解的是 (填字母)。
A. B.
C.
D.
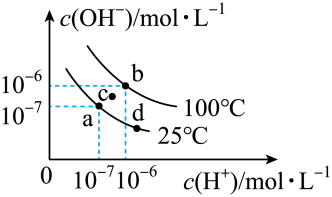
②常温下,向溶液中滴入
的
溶液,溶液的
变化曲线如图所示,d点溶液中
(保留两位有效数字);b点溶液中:
(填“>”“<”或“=”)
。
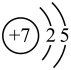
①常温下要使降低为
, 溶液的
应调至。
②向硫酸铜溶液中通入
气体,该反应的离子方程式为,当溶液中的
时,
。

①若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会(填“增大”“不变”或“减小”)。
②若c点溶液中溶质的总物质的量为 , 向c点溶液中加入
的
, 此时溶液满足的元素质量守恒式为。
i:
;
ii:
iii:
①根据盖斯定律,反应iii中的。
②化学反应的焓变与反应物和生成物的键能(气态分子中化学键解离成气态原子所吸收的能量)有关。已知某些化学键的键能如下表所示:
共价键 | ||||
键能 | 339 | 246 | a | 120 |
结合(1)中反应原理a=。

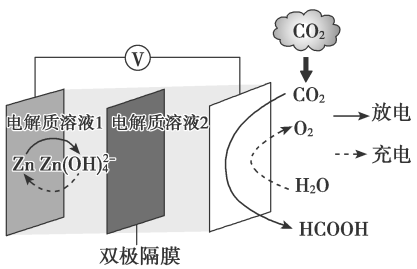
①进入电解池的溶液中,溶质是(填化学式)。
②阳极的电极反应式为。

①在密闭容器中,关于上述反应的说法正确的是(填字母)。
A.随温度的升高而增大
B.低压有利于提高的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:的平衡转化率为;
时,反应
的
(
为以分压表示的平衡常数,分压=总压×物质的量分数)。