
|
|
|
|
A.在铁制品上电镀铜 | B.制作水果(柠檬)电池 | C.将 | D.粗测碳酸钠溶液的 |
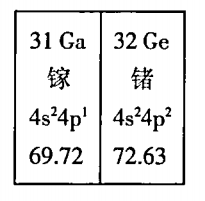
①R的原子序数为26
②依据核外电子排布,把元素周期表划分为5个区,R位于ds区
③基态的价层电子轨道表示式为
![]()
①当滴加溶液至溶液中的
时,溶液的
7(填“<”“=”或
“>”,下同),此时(
溶液)
。
②该温度下,反应的平衡常数
(列出计算式即可)。
①达到滴定终点的现象是。
②某同学第一次滴定后标准溶液的液面如图所示,读数为
。
③平行滴定三次的实验数据如下表所示,请计算待测溶液的浓度为
。

实验次数 |
| 待测 |
1 | ② | 25.00 |
2 | 24.71 | 25.00 |
3 | 24.69 | 25.00 |
查阅资料:高铁酸根()在溶液中呈紫红色。
转化率随反应温度的变化关系如图所示:

曲线的进料浓度比[
(乙苯):
]为,判断依据是。

已知该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的如下表所示:
金属离子 | ||||
开始沉淀的 | 2.3 | 6.8 | 4.7 | 6.2 |
完全沉淀的 | 3.2 | 8.3 | 6.7 | 8.2 |
回答下列问题:

已知:该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表:
金属离子 | |||
开始沉淀( | 2.2 | 6.8 | 7.7 |
沉淀完全( | 3.2 | 8.3 | 9.2 |
回答下列问题:
②写出“沉钴”时发生反应的离子方程式:。