|
|
|
|
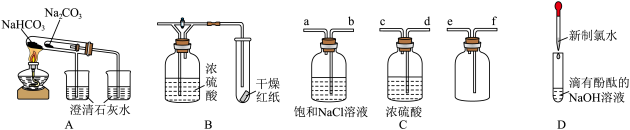
A.火药使用 | B.用 | C.转轮排字 | D.用氧化铁冶炼铁 |
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶, 再通过盛有浓硫酸的洗气瓶 |
④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
①氨水;②熔融;③
固体;④
固体;⑤铜;⑥蔗糖
![]()
以下说法不正确的是( )
A.酸性溶液 B.氯水 C.溴水 D.硝酸溶液 E.过氧化氢溶液
①把称量好的绿矾放入小烧杯中,加适量蒸馏水溶解;
②待溶液恢复到室温;
③把①所得溶液小心转入____中;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
⑤继续向容量瓶中加蒸馏水至液面距离刻度1~2cm处,改用____滴加蒸馏水至液面与刻度线相切;
⑥将容量瓶塞紧,反复上下颠倒,摇匀。
请填写下列空白:
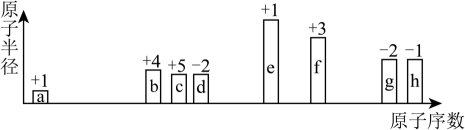
族 周期 | ⅠA | 0 | |||||||
1 | ⅡA | ~ | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | ||
2 | ① | ||||||||
3 | ② | ③ | ④ | ⑤ | |||||
②、③、④三种元素的单质与酸反应的剧烈程度的次序为>>(填元素符号),从原子结构的角度解释原因。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.单质作为还原剂的时候,失去电子个数
a.只具有还原性
b.Se的最低负化合价是价
c.Se的气态氢化物的稳定性比①的强
ⅰ:
ⅱ:……
①写出ⅱ的离子方程式:。
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的溶液中加入
溶液,溶液几乎无色,再加入少量
, 溶液变红。
b.。
实验1 | 试剂 | 现象 | |
试管 | 滴管(各1滴) | ||
|
| a.饱和氯水 | 溶液立即变为浅红色 |
b.稀硝酸 | 溶液立即变为红色 | ||
c.5% | 溶液立即变为深红色,无气体产生 | ||
①该实验的目的是。
②用离子方程式表示a中出现浅红色的原因:、。
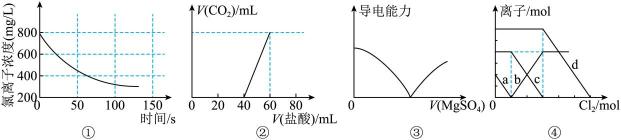
假设1:氯水加入量少,氧化生成的
浓度低。
设计实验ⅰ排除了假设1:取a中浅红色溶液,操作a , 观察到溶液浅红色消失
假设2:氯水氧化性强,氧化了部分。
(已知:与
可在溶液中大量共存;
易被氧化为
)
进行实验ⅱ证明假设2成立:向水中滴加1滴
溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有
。
①操作a为。操作b是。
②补全ⅱ中被
氧化的离子方程式:
=
实验2 | 试管 | 消耗 |
| d. | 2.40 |
e.实验a中溶液 | 1.52 | |
f.实验b中溶液 | 1.60 | |
g.实验c中溶液 | 1.84 |
则由d~g可以得出的结论是(答出2点)。