
 D .
D . 电池有铅蓄电池、燃料电池(如电池)、锂离子电池、
一次氯酸盐电池等,它们可以将化学能转化为电能。
都可用作燃料电池的燃料。
的燃烧热为
。电解则可以将电能转化为化学能,电解饱和
溶液可以得到
, 用电解法可制备消毒剂高铁酸钠
。

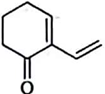 与
与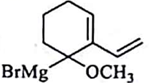 C .
C . 选项 | 探究目的 | 实验方案 |
A | 钾元素的焰色试验 | 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
B |
| 向 |
C |
| 向 |
D | 比较溶液中 | 用 |
①的基态核外电子排布式为.
②“除杂”包括加入溶液调节
、加入足量
除去
和
、过滤等步骤。调节溶液
的目的为。
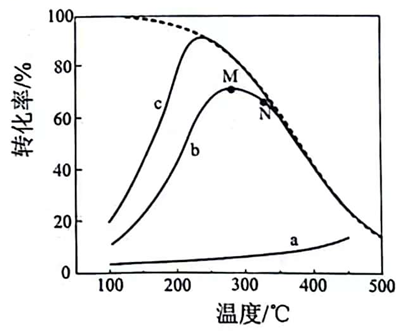
③“电解精炼”时,以粗镓为阳极,含的碱性溶液为电解液,阴极析出镓的电极反应式为;阴极同时有少量气体产生。测得电解过程溶液中镓浓度与电流效率(
)随时间的变化如图2所示。反应
后,
降低的原因是。
图1 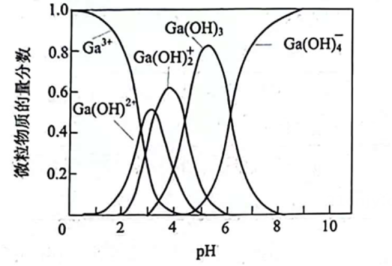 图2
图2
①制得GaN时生成一种有机物的化学式为。
②的一种晶胞如图3所示。晶体中距离
最近且相等的
的数目为。

图3
③准确称取样品,加入
溶液,加热使固体充分溶解,用足量
溶液吸收产生的
。向吸收液中滴加指示剂,用
的盐酸滴定至终点,消耗盐酸
。
过程中涉及反应:;
, 计算
样品的纯度(写出计算过程)。
①加入反应物的正确顺序是:c、、(填字母)。
②硝化反应的机理可表示为:

反应中浓硫酸的作用是。
碱性条件水解后酸化生成两种产物,产物之一能与溶液发生显色反应,两种产物的核磁共振氢谱中都有2个峰。
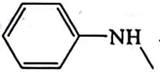 、
、 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用)。
的合成路线流程图(无机试剂和有机溶剂任用)。
 )按一定比例混合搅拌至形成均一透明液体,制得DESs。
)按一定比例混合搅拌至形成均一透明液体,制得DESs。
图1
①DESs由含氢键供体(能形成氢键的氢原子)的组分与含氢键受体(能与氢原子形成氢键的原子)的组分混合。乙二醇分子中氢键供体的数目为。
②不同配比氯化胆碱与乙二醇混合的二元相图如图1所示。相同条件下,氯乙二醇的熔点乙二醇的熔点(填“>”“二”或“<”)。制备熔点达到最低值的DESs时,氯化胆碱与乙二醇的物质的量之比为。
①冷凝管的作用为。
图2 图3
图3
②主要反应机理如图3所示:
Ⅰ中碳原子轨道杂化类型的变化为;M的化学式为。
已知: , 完全沉淀时离子浓度小于
;
易溶于水;
的溶解度:
为
为
为
。补充完整由粗
溶液(含少量
)制备
的实验方案:向粗
溶液中,得到
固体。
(须使用的试剂:溶液、
溶液)


图1
①X的结构简式为。
②催化剂表面存在和
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于(填“
”或“
”)活性位点。已知:
键、
键的键能分别是
。肼在该催化剂表面反应断裂的化学键不是
键,而是
键,原因是。
③催化剂存在下,不同浓度的分解时,测得
随时间的变化如图2所示。当
浓度从
增加到
时,反应速率加快;从
增加到
时,反应速率几乎不变。其原因是。

图2