 D .
D . 
氧化物
酸(或碱)
盐
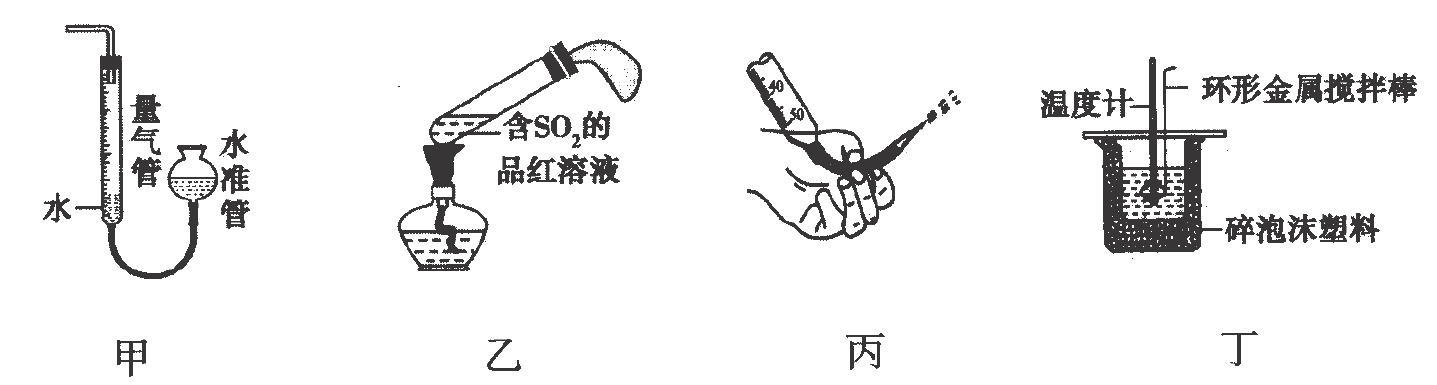
选项 | 目的 | 操作 |
A | 除去氯气中混有的氯化氢气体 | 通入盛有饱和 |
B | 除去自来水中含有的氯离子等杂质 | 将自来水进行蒸馏 |
C | 除去氧化铁中混有的氧化铝 | 加入足量的 |
D | 除去乙酸乙酯中混有的少量乙酸 | 加入饱和 |
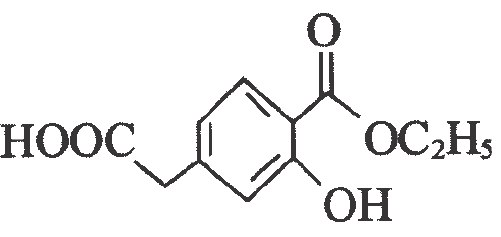
上述物质有如图转化关系:
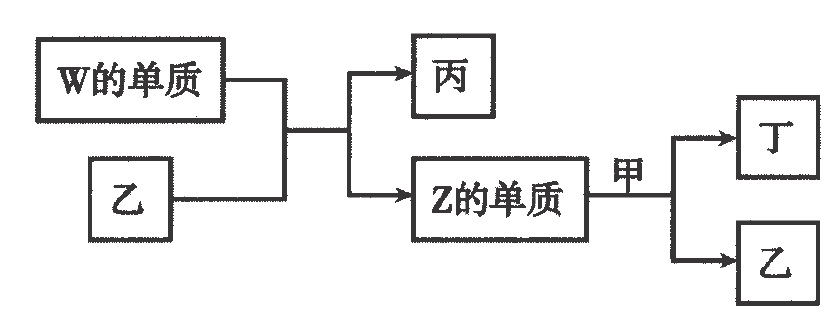
下列说法正确的是( )
选项 | A | B | C | D |
装置和试剂 |
|
|
|
|
实验目的 | 制取 | 获取 | 比较非金属性: | 获得纯净的 |
选项 | 操作 | 现象 | 结论 |
A | 向溴水中加入苯,振荡后静置 | 水层颜色变浅 | 溴与苯发生了加成反应 |
B | 向 | 溶液由黄色变为橙色 | 增大 |
C | 向 | 上层颜色无明显变化,下层呈橙色 | 还原性 |
D | 用 |
| 酸性: |
酸 | |||||
浓度 | 0.12 | 0.2 | 0.9 | 1 | 1 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | |||||
【实验一】配制溶液
取固体样品配制成
溶液
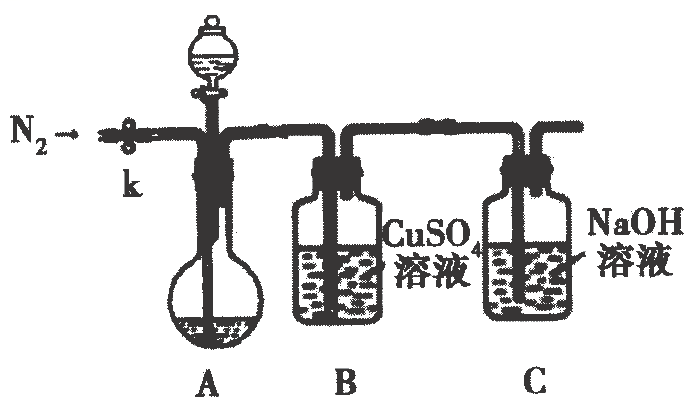
实验装置如下图所示,取上述溶液
于圆底烧瓶中,滴加足量
稀
, 充分反应,关闭活塞.待反应结束后打开止水夹k,通入一段时间
.
已知:①
②是不溶于水、比水重、易挥发(沸点为
)的无色液体;
与
某些性质相似,与
溶液反应生成
和
实验小组设计如下两种实验方案测定样品纯度
方案1:通过测定B中产生沉淀的质量,计算样品纯度
B中发生反应的离子方程式;
反应结束后,通入的最好是
左右的热
, 其目的是;
反应原理为: .
该过程的流程如图:
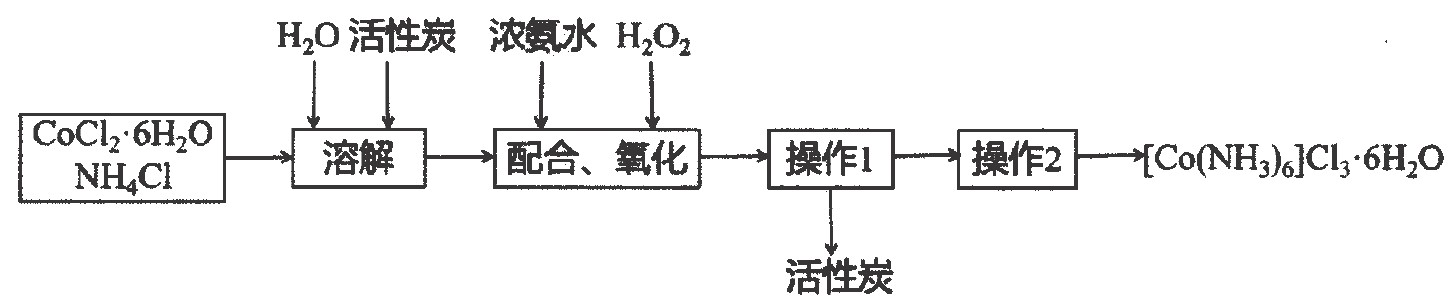
已知:
①不易被氧化,
具有较强还原性.
②难溶于无水乙醇,在水中的溶解度随温度升高而增大.
③加入浓盐酸有利于晶体析出.
回答下列问题:

①盛放混合液仪器的名称;
②干燥管盛放的药品可以是;
a.浓硫酸 b.五氧化二磷 c.碱石灰
③向混合溶液中首先滴加(填入“溶液”或“浓氨水”),完成该步骤的具体操作是;
④“配合、氧化”过程中,控制混合液温度不高于的原因;

①工业上,常选用作为合成温度,原因是;
②时,经过t分钟反应达平衡,t分钟内用
表示的反应速率为
;该温度下
对甲烷的选择性=
(已知:选择性);

①c点(填“达平衡”或“未平衡”)
②主反应活化能(正)
(逆)(填“>”或“<”),代表
的曲线是(填“
”或“
”);
③温度下达平衡时总压为p,该反应的
(列出计算式);