选项 | 胶体的性质或应用 | 胶体的结构特点 |
A | 利用半透膜分离胶体中的杂质离子 | 分散质微粒带同种电荷 |
B | 明矾在水中形成胶体从而净水 | 分散质具有巨大的比表面积 |
C | 利用丁达尔现象鉴别溶液与胶体 | 分散质微粒直径在1~100 nm之间 |
D | 土壤对 | 土壤胶粒带负电 |

①需用量筒量取98%的浓硫酸(密度为)mL。
②下列情况会导致所配溶液浓度偏高的是(填标号)。
a.定容后摇匀时有少量溶液溅出
b.定容时仰视容量瓶瓶颈上的刻度线
c.使用量筒量取浓硫酸时仰视刻度线
d.硫酸溶液移入容量瓶后没有洗涤烧杯
e.稀释后未冷却即进行移液、定容等操作

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:

已知:SO2Cl2熔点为-54.1℃,沸点为69.1℃,遇水迅速反应生成两种强酸,且高温条件下不稳定。
回答下列问题:
a.氯酸钾 b.二氧化锰 c.浓硝酸 d.漂白粉
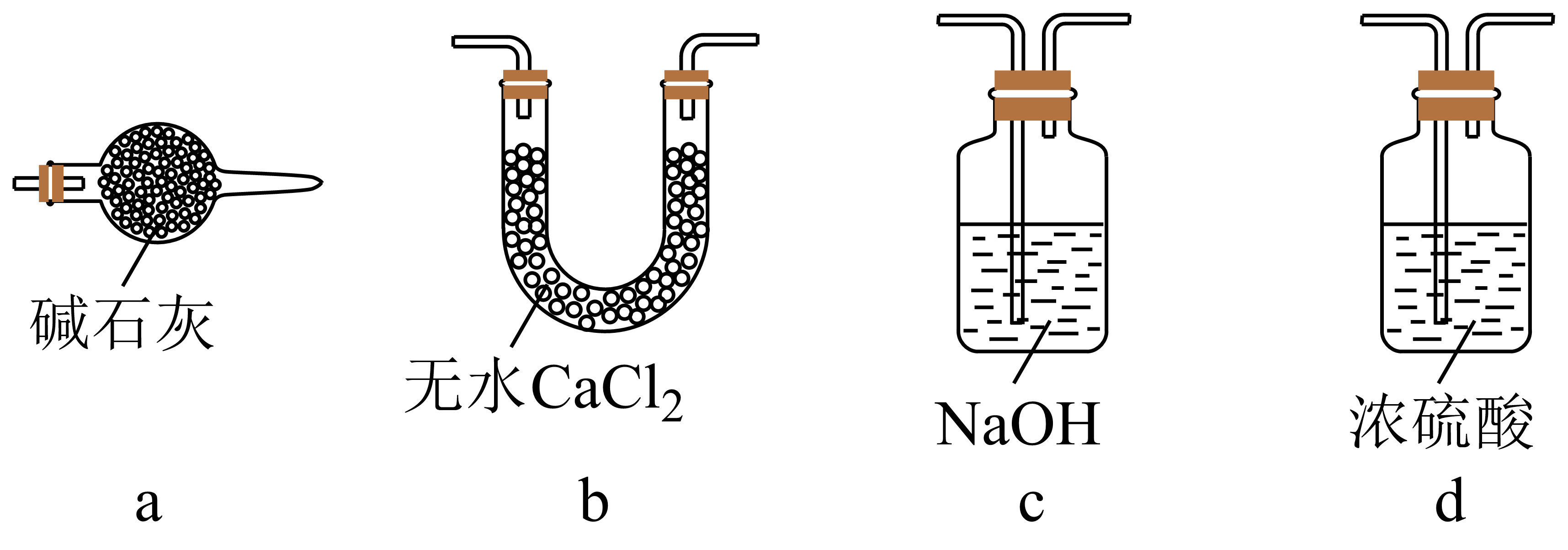
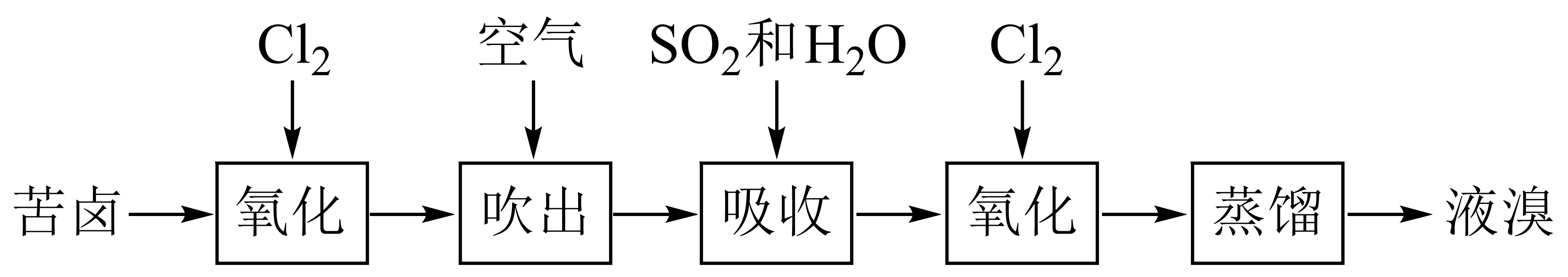
以苦卤为原料提Br2而不是直接利用海水提Br2 , 优势在于。
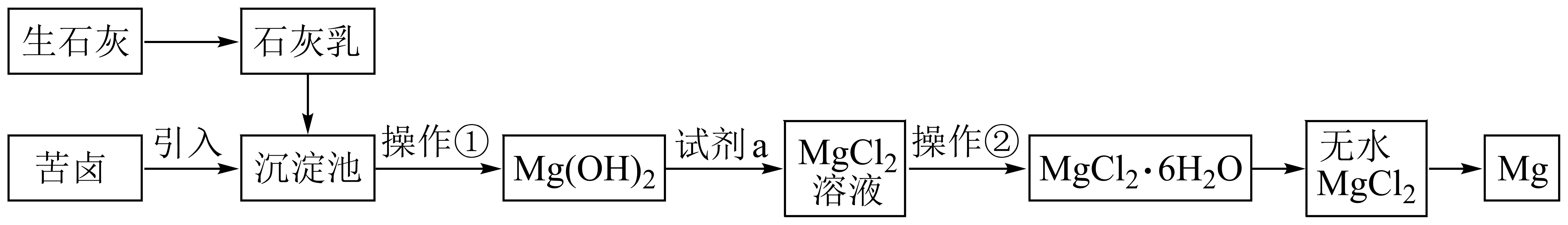
已知:MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
沉淀池中发生主要反应的离子方程式为。
a.N2 b.Ar c.CO2 d.O2
已知:能被氧化为黄色的
,
可聚合为红色的
。
取2 mL浓硝酸于试管中,向其中滴加5滴的KSCN溶液,溶液立即变红,静置一段时间后,试管内突然剧烈反应,红色退去,放出大量红棕色气体。
将实验一放出的气体通入和NaOH的混合溶液中,有白色沉淀生成。将过滤、洗涤后的白色沉淀置于试管中,加入过量稀硝酸,沉淀完全溶解。
该实验证实了红棕色气体中不含SO2 , 证据是,白色沉淀为。
另取少量实验一最终所得溶液,(填操作和现象),证明溶液中含有。
某同学向待测溶液中加入KSCN溶液,再加入浓硝酸,最终未得红色溶液,由此得出结论:待测液中不含。
你认为该同学的结论是否正确:(填“是”或“否”),理由是。