
选项 | 实验目的 | 实验方案 |
A | 测定NaClO溶液的pH | 取一张 pH 试纸放在表面皿上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,与标准比色卡对比 |
B | 探究浓度大小对反应速率的影响 | 取等体积不同浓度的KMnO4溶液,分别加入等体积等浓度的H2C2O4溶液,观察褪色的快慢 |
C | 检验CH3CH2Br 中的溴原子 | 取少量CH3CH2Br与NaOH 水溶液共热,冷却,再加AgNO3溶液,观察产生沉淀的颜色 |
D | 探究KI与FeCl3反应的限度 | 取5mL 0.1mol/L KI溶液于试管中,加入1mL 0.1 mol/L FeCl3溶液,充分反应后再加KSCN溶液,观察现象 |
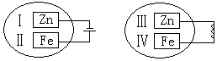
选项 | 物质 | 所用试剂 | 方法 |
A | 乙醇(水) | 新制生石灰 | 蒸馏 |
B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
D | 饱和碳酸钠溶液 | 过滤 |
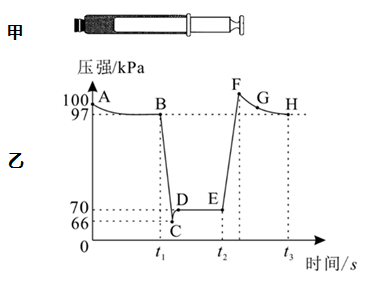
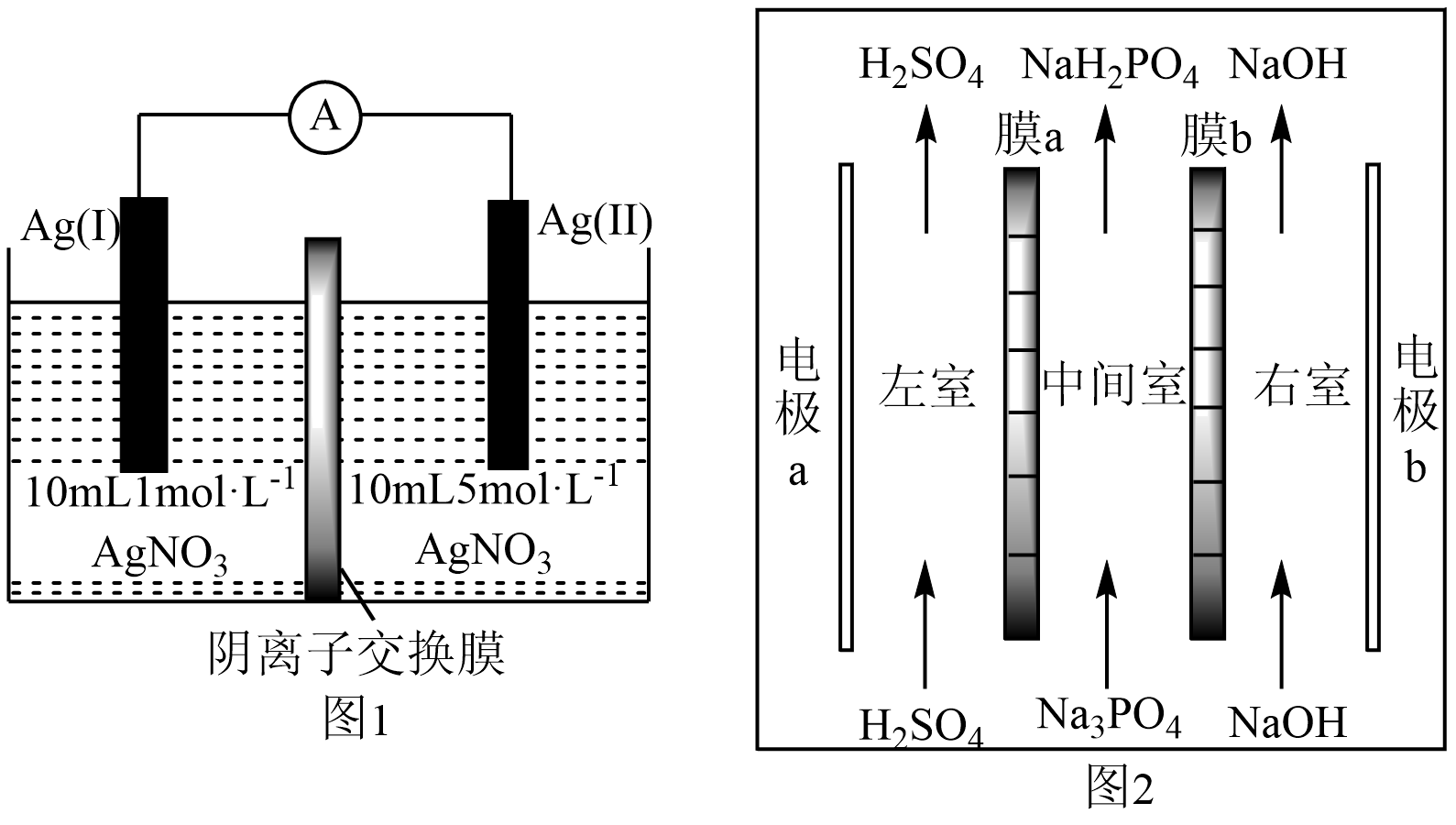
第一步:ClO-+H2OHClO+OH- K1=3.3×10-10
第二步:…… K2=……
第三步:HIO+OH-IO-+H2O K3=2.3×103
下列说法正确的是( )
□CuSO4+□PH3+□H2O = □Cu3P↓+□H3PO4+□H2SO4

①白磷和烧碱溶液反应的化学方程式为。
②从分类来看,NaH2PO2属于。
A.正盐B.酸式盐C.强电解质D.弱电解质
③NaH2PO2可将溶液中的Ag+还原为银,从而用于化学镀银。已知利用此原理进行化学镀银时氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为 (填化学式)。
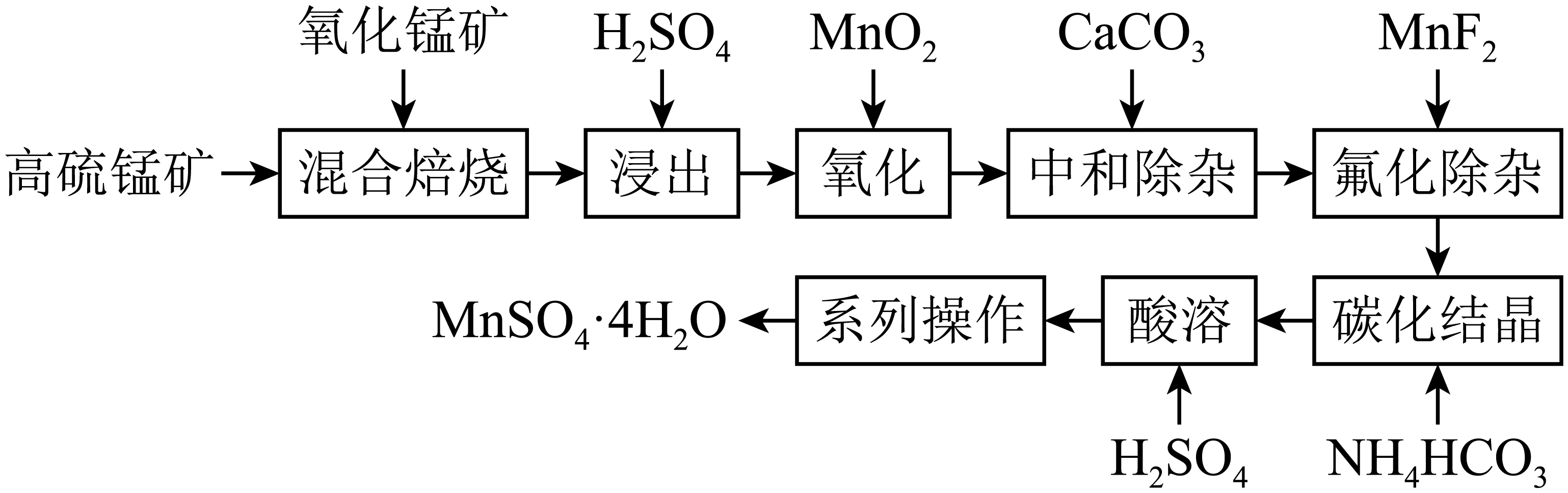
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO
② Ksp(MgF2)=6.4×10-10(mol/L)3;Ksp(CaF2)=3.6×10-12(mol/L)3
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答:

①CO2(g)+3H2(g) CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
③CO(g)+2H2(g)CH3OH(g) ΔH3= -90.6kJ/mol
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
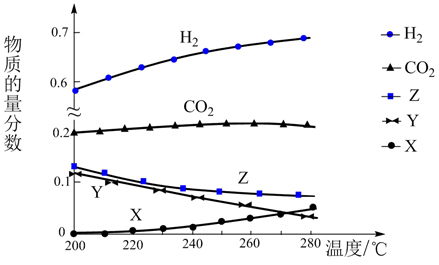
①体系中CO2的物质的量分数受温度的影响不大,原因是。
②如上图X、Y分别代表、(填化学式)。
