

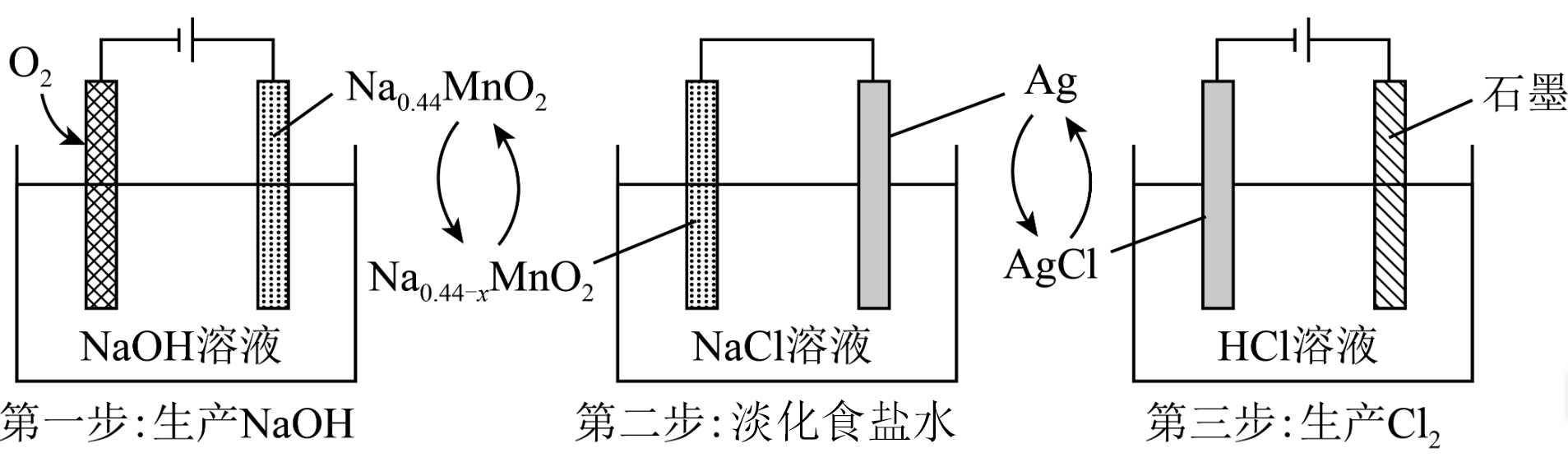
实验Ⅰ
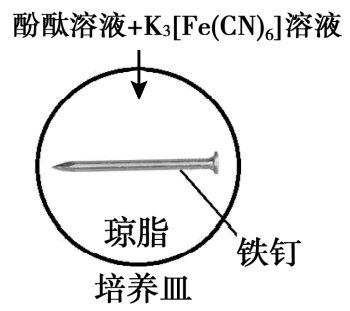
5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
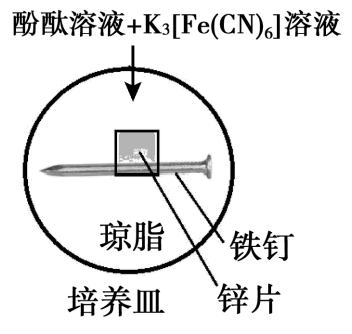
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是( )
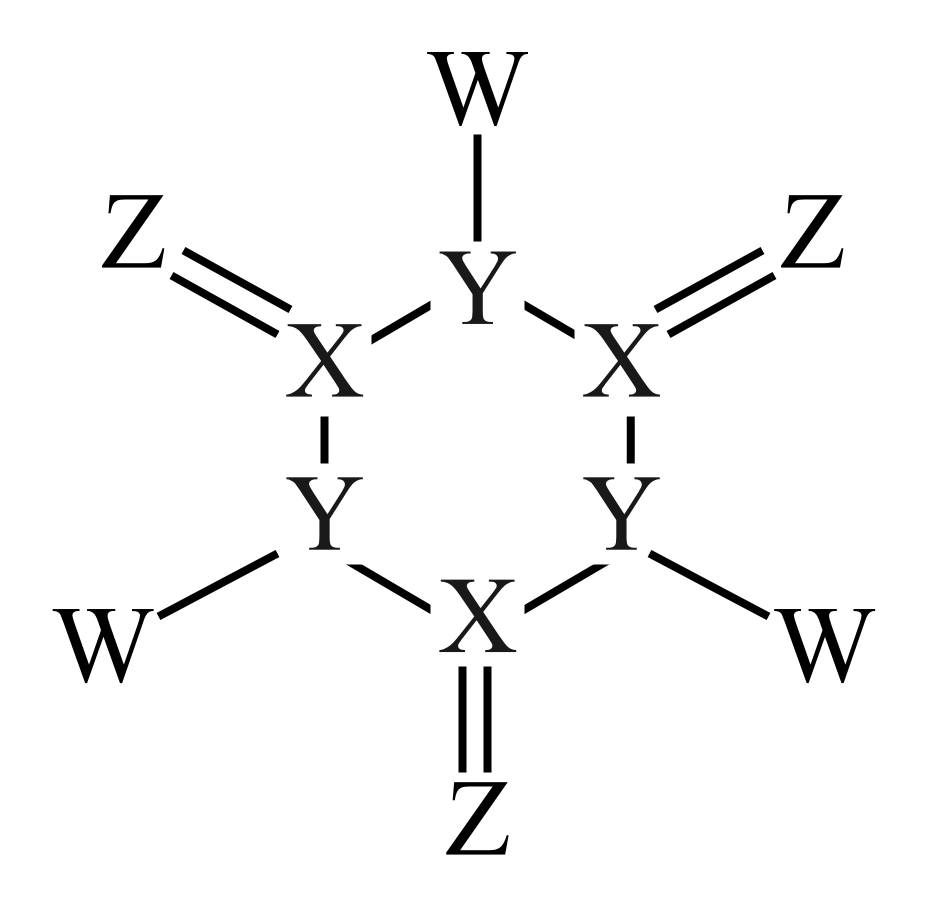
选项 | 实验目的 | 实验操作 |
A | 提纯Mg(OH)2 | 将含少量Cu(OH)2的Mg(OH)2固体溶于足量浓氨水中,过滤、洗涤、干燥 |
B | 探究Fe2+、I-的还原性强弱 | 在FeI2溶液中滴加酸化的双氧水,观察溶液颜色变化 |
C | 判断KCl的化学键类型 | 将KCl固体加热融化,进行导电性实验 |
D | 探究不同价态硫元素的转化 | 向Na2S与Na2SO3的混合溶液中加入硝酸 |
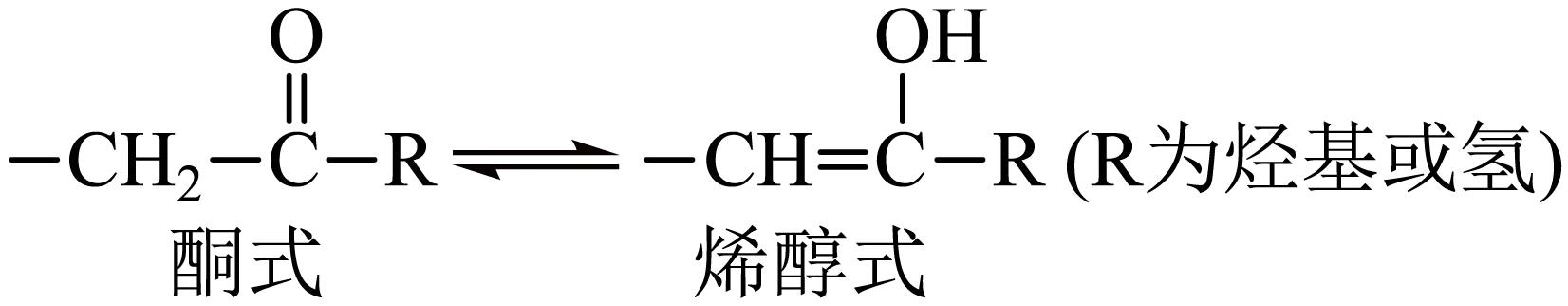
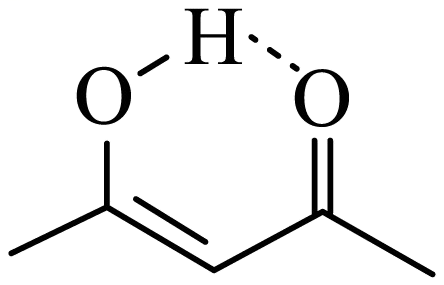
已知。回答下列问题:
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键

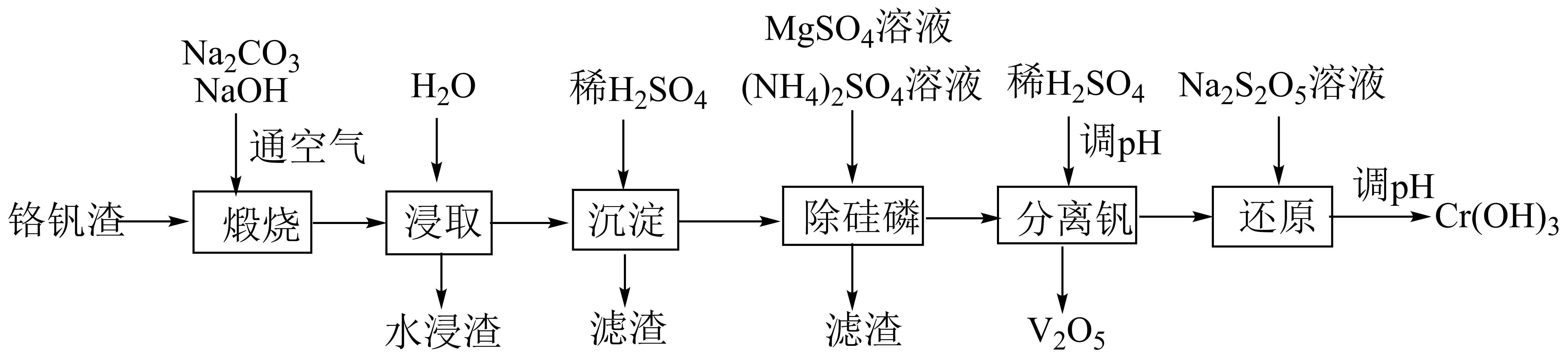
已知:最高价铬酸根在酸性介质中以Cr2O存在,在碱性介质中以CrO
存在。
回答下列问题:

已知:I.有关物质性质如下表所示:
甘氨酸 | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度 |
柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性 |
甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸 |
II.甘氨酸亚铁摩尔质量为
III.氨基能被酸性溶液氧化为硝基:
①打开、
, 反应一段时间,将装置中空气排净;
②,使b中溶液进入c中;
③在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5~6.0,使反应物充分反应;
④反应完成后,向c中反应混合液中加入乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品。
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率(%) | 65.70 | 74.92 | 78.67 | 86.65 | 88.07 | 74.97 | 62.31 | 55.98 |
pH过高或过低,产品产率均下降的原因是:。
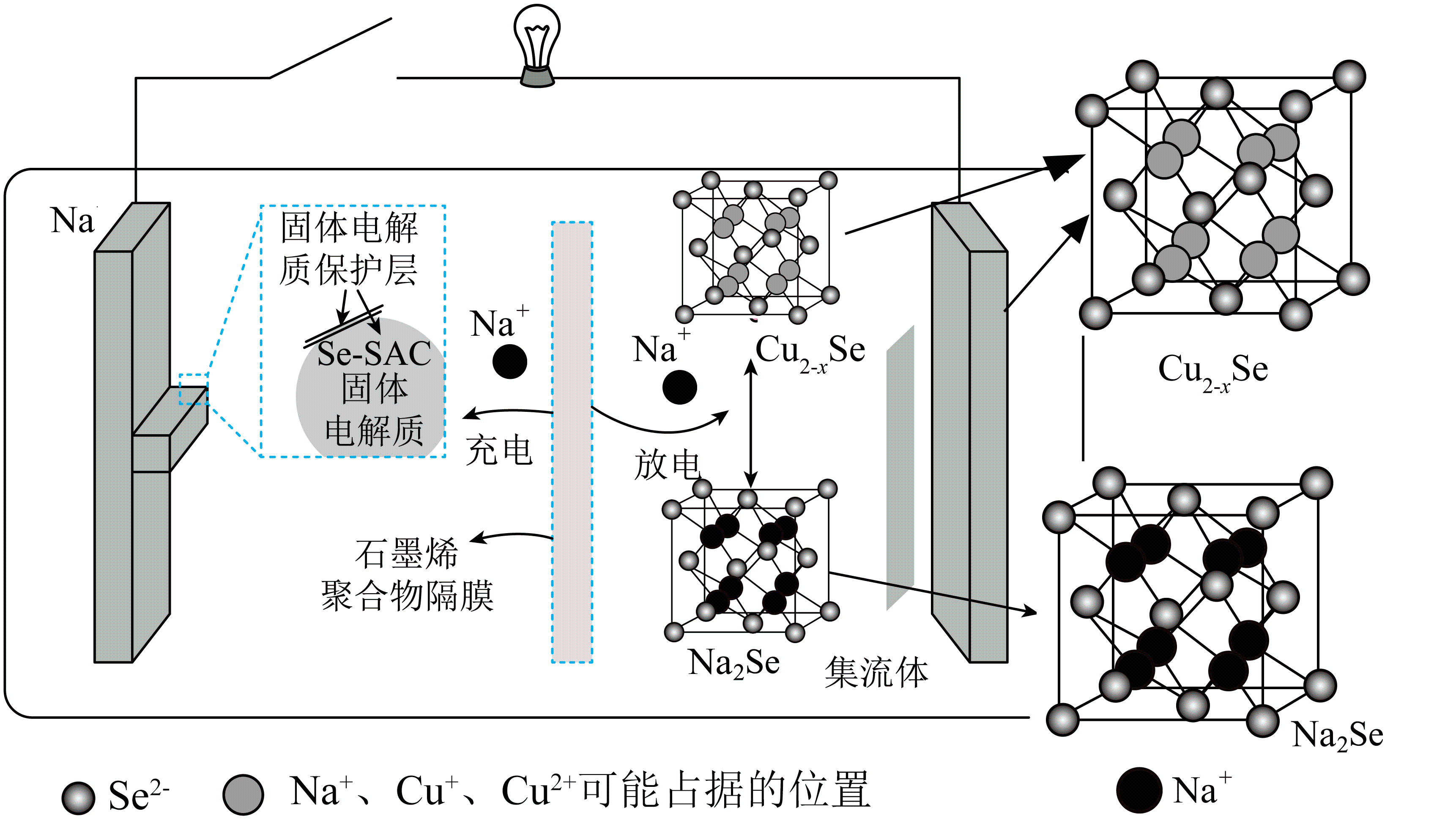
I.
II.
反应。(用
表示)
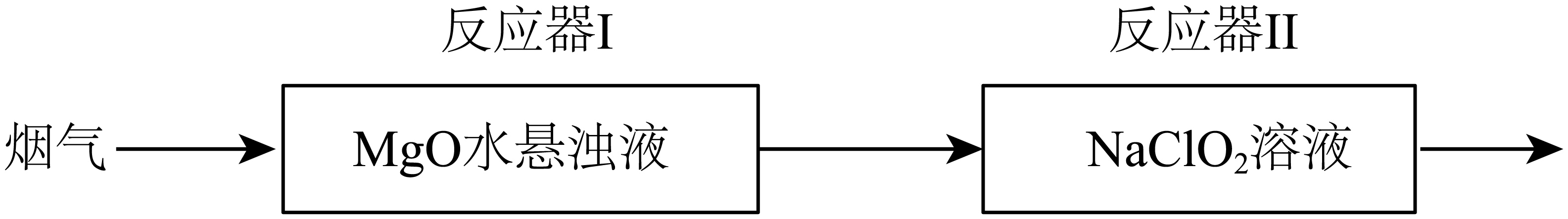
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式。
②反应器II中所发生的反应为 , 盛有
溶液最多能吸收
(标准状况下)的体积为。
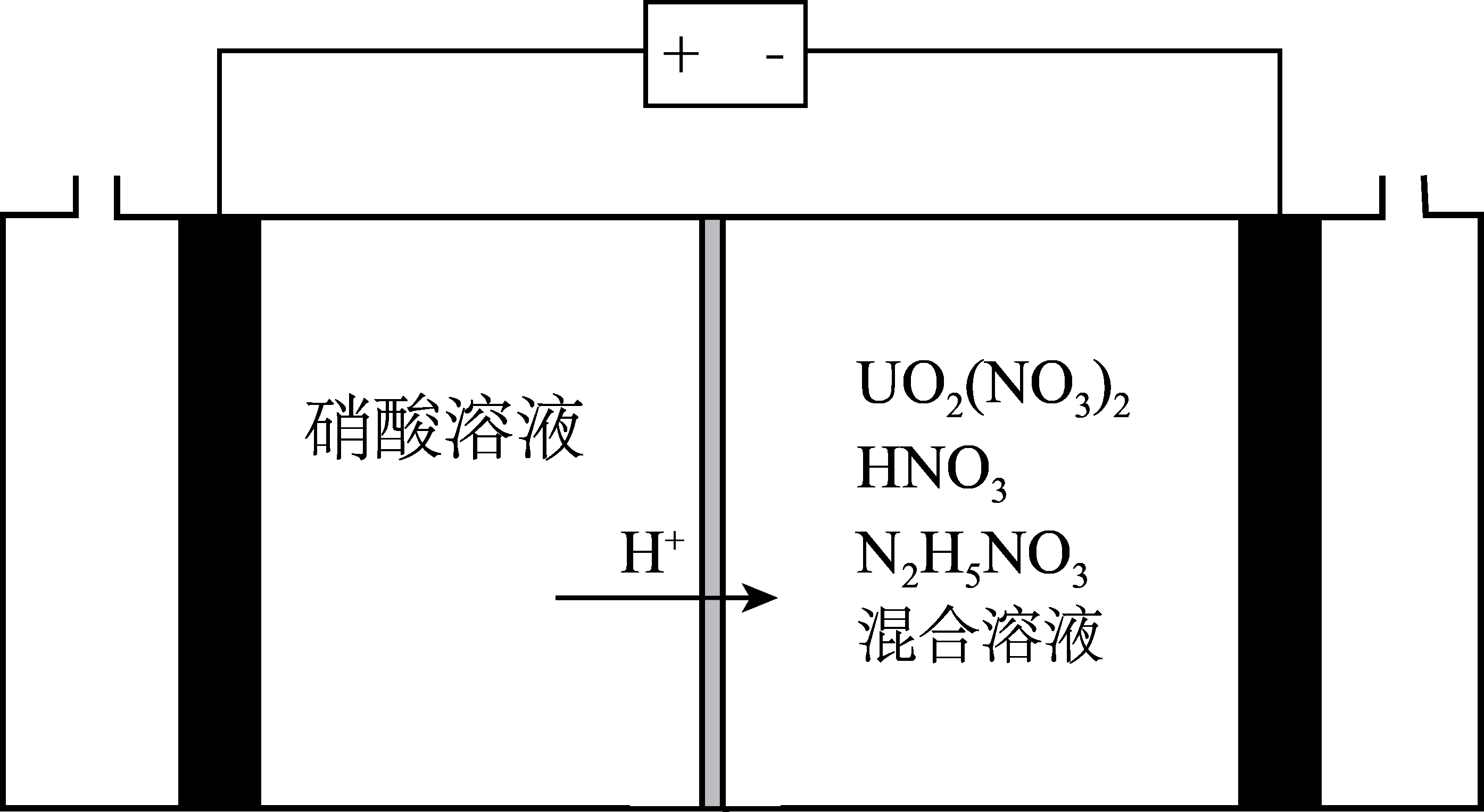
阴极发生的反应为: , 阴极区溶液中发生反应:
、
。
①阴极上发生的副反应为:。
②阴极区溶液中加入的目的是。
③电还原处理+6价的铀转移
, 阴极区
减少mol。
①能使溶液显色;②既能发生银镜反应,又能发生水解反应