 D . 铝离子的结构示意图:
D . 铝离子的结构示意图:

A | B | C | D |
| | | |
探究氧化性:KMnO4>Cl2>I2 | 加热熔融的纯碱固体 | 实验室里接收用自来水制取的蒸馏水 | 除CO2中的HCl杂质 |

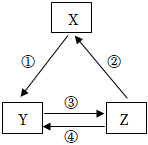
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 |
B | Na2CO3 | NaCl | NaHCO3 | ③先通NH3、再通CO2 |
C | Na | NaOH | NaCl | ②电解饱和食盐水 |
D | Si | Na2SiO3 | H2SiO3 | ②加热 |
选项 | 操作 | 现象 | 解释(或结论) |
A | 向补铁口服液中滴加几滴酸性KMnO4溶液 | 紫色褪去 | 补铁口服液中一定含有Fe2+ |
B | 向I2水中先加足量浓NaOH溶液,再加适量CCl4 , 振荡后静置 | 液体分层,上层无色,下层紫红色 | CCl4能萃取碘水中的碘,而NaOH溶液不能 |
C | 激光笔照射微蓝色透明的硫的酒精溶液 | 激光笔照射时产生光亮的通道 | 微蓝色透明的硫的酒精溶液属于胶体 |
D | 向装有某未知溶液的试管中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 湿润的红色石蕊试纸未变蓝 | 证明溶液中无NH4+ |
①Cu与Cu2O的物质的量之比为1:2
②硝酸的物质的量浓度为2.8mol•L-1
③Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
④产生的NO标准状况下体积为2.24L
⑤原混合物中Cu的质量分数为52.9%

A.在化合物中④的化合价比⑥的低
B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强
D.④单质的熔点比⑥单质的低
Ⅰ、已知H3PO2是一种一元弱酸,向Ba(H2PO2)2 溶液中加入H2SO4制备H3PO2 , 写出该反应的离子方程式 ;
Ⅱ、NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni﹣P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高
b.降低
c.既升高又降低

已知:
Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)2O3),难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
 ”环节的目的是 。
”环节的目的是 。

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为。


已知:①NH3不溶于CS2 , CS2不溶于水且密度比水大。
②三颈烧瓶内发生反应CS2+3NH3NH4SCN+NH4HS,NH4HS在25℃时易分解生成NH3和H2S。
③从0~100℃,KSCN溶解度为177g~675g。
回答下列问题:
称取1.00g实验产品,用蒸馏水溶解后,定容于100mL容量瓶中,移取20.00mL于锥形瓶中,加入几滴Fe(NO3)3溶液,用0.1000mol•L﹣1AgNO3标准溶液滴定,平行测定三次,消耗AgNO3标准溶液体积的平均值为20.00mL。
①滴定时发生的离子反应为SCN﹣+Ag+═AgSCN↓ (白色),则终点时的现象是 。
②产品中KSCN的质量分数为 。(保留2位有效数值)
①遇FeCl3溶液显紫色;②能够发生银镜反应;③结构中不含有﹣O﹣O﹣键。
其中在溶液中能够与NaOH以物质的量之比为1:3发生反应,且核磁共振氢谱显示有4组峰,峰面积之比为1:1:2:2的物质的结构简式为 。