选项 | 归类 | 内容 |
A | 清洁能源 | 煤炭、石油、太阳能 |
B | 糖类物质 | 蔗糖、淀粉、纤维素 |
C | 酸性物质 | 胃液、食醋、肥皂水 |
D | 合成材料 | 塑料、涤纶、玻璃钢 |
选项 | 物质 | 目的 | 主要实验操作 |
A | H2、CH4 | 鉴别 | 点燃,在火焰上方罩一个干冷的烧杯,观察现象 |
B | NaOH溶液中混有Na2CO3 | 除杂 | 加入适量的CaCl2溶液,振荡、静置、过滤 |
C | Na2CO3溶液中是否含有Na2SO4 | 检验 | 取样,滴加BaCl2溶液,观察现象 |
D | KNO3和Ba(NO3)2的混合溶液 | 分离 | 先加入过量的K2CO3溶液,搅拌、静置、过滤、洗涤,再分别向滤液、滤渣中加入适量的稀硝酸,搅拌 |
A.氧气 B.熟石灰 C.聚乙烯 D.硝酸铵 E.食盐 F.硫酸铜 G.维生素 H.苛性钠

①16.0g甲烷理论上可制备氢气的质量为g。
②“分离“时发生反应的化学方程式为。
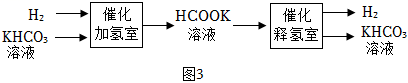
①催化加氢室发生反应的化学方程式为。
②采用HCOOK溶液释氢优于HCOOH释氢,原因有产生H2的速率快和。
③在氢气的贮存和释放中可循环使用的物质是。

已知:此实验条件下Na2CO3溶液的pH≈11.6,NaHCO3溶液的pH≈8.3。
①装置G的作用是。
②实验50s时装置H溶液中的溶质是。
③实验150s时显示器中曲线pH<7的原因是。
【猜想】白色固体为:①MgCO3;②Mg(OH)2;③xMgCO3•yMg(OH)2•zH2O。
【实验1】称取3.64g白色固体,加入过量的稀盐酸,出现气泡,则猜想(填序号,下同)不成立。将产生的气体全部通入过量的澄清石灰水中,产生3.0g沉淀,则猜想成立。
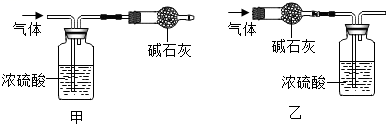
实验测得浓硫酸的质量增加1.44g,碱石灰的质量增加2.64g,则x:y:z=。

①“或用木炭,……扇炉风箱,……土(铁矿石)化成铁……”描述了古代练铁的方法。用化学方程式表示用赤铁矿炼铁的原理:。
②对生铁炼钢的描述有:“凡钢铁炼法,……火力到时,生铁先化。”说明生铁的熔点比钢。
③“烧铁器淬胆矾水中,即成铜色也”,句中蕴含的化学反应基本类型是。
①检测锈蚀产物
主要成分 | |||
Fe3O4 | Fe2O3•H2O | FeOOH | FeOCl |
说明铁器在含有O2、和盐等环境中容易被腐蚀。
②化学修复出土铁器可通过脱氯、还原、形成保护层来实现,原理如下。
FeOClFeOOH
Fe3O4
脱氯时发生反应的化学方程式为,还原时铁元素的化合价(选填“部分”“全部”或“没有”)降低。
Fe3O4是合成氨催化剂的主要成分。用铁泥(主要成分为Fe2O3、FeO,含少量Fe)制备Fe3O4的主要流程如下。
“还原”时,Fe可将Fe2(SO4)3转化为FeSO4 , 该反应的化学方程式为。
合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”。在一定温度下可用O2将其“再生”,原理如图2所示。“再生”过程中铁元素的质量分数(选填“变大”“变小”成“不变”)。
①M=。
②A点固体中m(FeO):m(Fe3O4)=.