
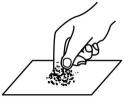
 B . 读取液体体积
B . 读取液体体积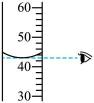 C . 二氧化碳的验满
C . 二氧化碳的验满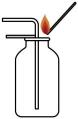 D . 倾倒液体
D . 倾倒液体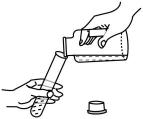
选项 | 实验目的 | 实验方案 |
A | 鉴别羊毛和棉花 | 灼烧,闻气味 |
B | 检验碳酸盐 | 滴加稀盐酸,观察是否有气体产生 |
C | 除去NaCl溶液中混有的CaCl2 | 加入适量Na2CO3溶液,过滤 |
D | 分离KCl和MnO2固体 | 溶解,过滤,洗涤、干燥。滤液蒸发结晶 |
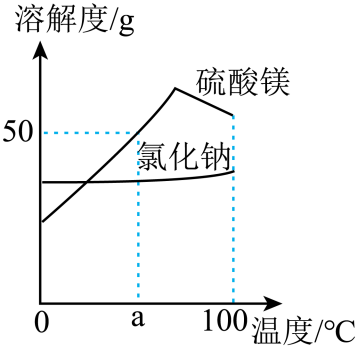
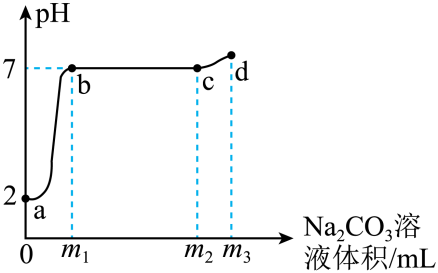
①取一定量的白色粉末加入足量水,得到无色溶液。
②向①所得溶液中加入过量Ba(OH)2溶液,产生白色沉淀,过滤,往沉淀中加入足量稀硝酸,沉淀部分溶解。
③往②滤液中先加入几滴无色酚酞溶液,溶液变红,然后加入过量稀盐酸,再滴入几滴硝酸银溶液,产生白色沉淀。
下列关于该白色粉末成分的判断,正确的是( )
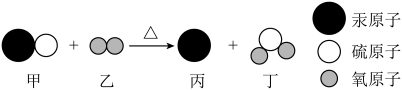
①生成黄铜的过程中,化合价升高的元素是。
②将黄铜投入硫酸铜溶液中,发生的反应方程式为。
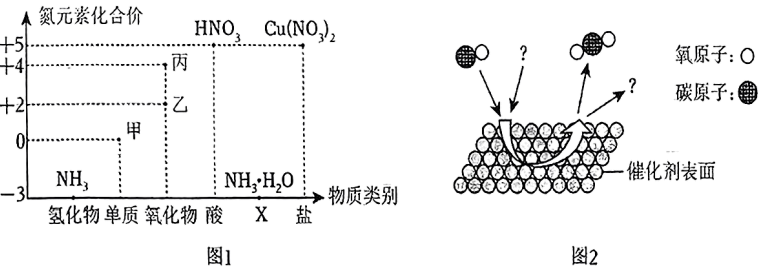
。
为减缓温室效应,我国政府向世界庄严承诺,力争在2060年前实现“碳中和”。“碳中和”是指采取多种方式去除二氧化碳,抵消一定时间内产生的二氧化碳排放量,实现二氧化碳的“净零排放”。
目前汽车使用的燃料主要是汽油,它燃烧后不仅会产生二氧化碳,还会释放多种有害物质。
开发能够取代汽油的新能源,研发、生产和使用环保、零污染的绿色汽车都是实现“碳中和”的有效措施。研发绿色环保汽车,主要有以下途径:一是改进现有车型,采用铝合金、钛合金、塑料等轻量化材料;二是开发汽车代用燃料,主要包括天然气、乙醇、生物柴油、氢气等,实现能源多元化;三是大力发展电动汽车,尤其是氢燃料电池汽车。
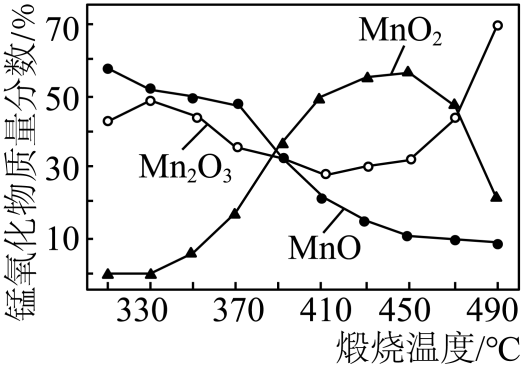
①370~410℃发生主要反应为。该反应属于基本反应类型中的反应。
②已知酒精灯外焰的最高温度可达600℃以上。称取一定质量的 , 与
混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。
质量减少的主要原因是。
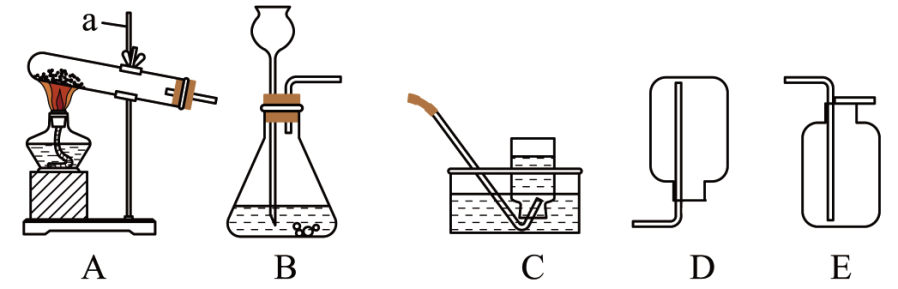
【任务一】设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。

称取若干份质量均为0.8000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2.
由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1.
经历 ,
两个反应,且在同一条件下两个反应同时进行。
假设2.
经历、
、
三个反应。
结合【任务二】的结果,通过计算分析,假设1“同一条件下两个反应同时进行”依据是。
操作 | 现象 | 结论 |
溶液变蓝色 | 假设2合理 |
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
锥形瓶+瓶内物质的总质量/g | 375.00 | 371.56 | 366.28 | 365.56 | 365.40 | 365.40 | 365.40 |