 粮食酿酒
B .
粮食酿酒
B .  冶炼生铁
C .
冶炼生铁
C .  烧制陶
D .
烧制陶
D .  棉纱织布
棉纱织布
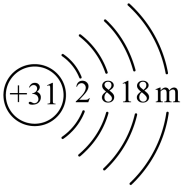
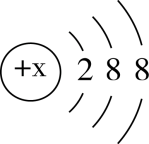 :只能表示氩原子的结构示意图
D . Ag:只能表示金属银
:只能表示氩原子的结构示意图
D . Ag:只能表示金属银
| 13Al 铝 26.98 | 14 X 28.09 |
30 Y 65.38 | 31 Z 69.22 | 32Ge 锗 72.63 |
| 甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g |
反应前 | 64 | 10 | 1 | 16 |
t 时刻 | 32 | a | x | y |
反应后 | 0 | 42 | b | 48 |
A.化学与安全 | B.化学与环保 |
①进入煤矿矿井前先做灯火实验 ②不能用手接触实验室中无毒的药品 | ①保护水资源——农业上禁止使用化肥与农药 ②减少温室气体排放——随手关灯 |
C.化学中的“一定”与“不一定” | D.化学中常见的“三” |
①纯净物不一定是由同种分子构成的 ②纯水一定是软水,软水不一定是纯水 | ①构成物质的三种微粒——原子、分子、离子 ②三种可加热仪器——试管、量筒、蒸发皿 |



选项 | 物质 | 杂质 | 除去杂质的方法 |
A | 银粉 | 锌粉 | 加过量硫酸亚铁溶液 |
B | MnO2 | KCl | 加水充分溶解,过滤,蒸发结晶 |
C | N2 | O2 | 伸入燃着的蜡烛 |
D | KNO3固体 | NaCl固体 | 加水溶解,蒸发浓缩,降温结晶,过滤,洗涤,干燥 |
|
|
|
|
A.分别向等质量的铁粉和锌粉中加入等体积等浓度过量的稀硫酸 | B.等量的稀硫酸分别与足量的铁粉和锌粉反应 | C.甲烷和过量的氧气在密闭容器中充分反应 | D.表示分别向等质量、等质量分数的稀盐酸中加入锌粉和铁粉 |

温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
氯化钠溶解度/g | 35 | 35.5 | 36 | 36.5 | 37 |
碳酸钠溶解度/g | 6 | 10 | 18 | 36.5 | 50 |
①t1℃时,NaCl的溶解度是g。该温度时,二者(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
②t2℃时,将40gNa2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为。
③在不改变溶质质量分数的前提下,要使接近饱和的Na2CO3溶液变为饱和溶液,可采取的措施是。

①图中操作错误的是(填序号)。
②配制溶液的正确操作顺序为(填序号)。
③经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是(填序号)。
A.氯化钠固体不纯 B.用生锈的砝码称量
C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠
④若要将100g10%的氯化钠溶液稀释成2%的溶液,需要另入水的质量为g。
①打开可乐瓶,溢出大量气体,由此可见,压强越小,CO2的溶解度越。
②不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度40℃,则t2对应的温度范围是。



请根据图示回答:

已知:Na2WO4溶液为无色;H2WO4是一种不溶于水的黄色固体;WO3难溶于水。

【查阅资料】
①“锡纸”是锡箔或铝箔与纸黏合而成;
②锌粉是一种深灰色固体;
③锡(Sn)与酸或金属化合物溶液反应生成+2价的锡的化合物。
【提出猜想】猜想I:该“锡纸”中的金属是锡;猜想Ⅱ:该锡纸中的金属是铝。
【进行实验】小明设计方案并进行实验。
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加稀盐酸 | “锡纸”表面有气泡产生 | 根据实验现象,小明认为“锡纸”中可能是锡(Sn),请写出锡和稀盐酸反应的化学方程式 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知,猜想(填“I”或“Ⅱ”)成立 |
①实验中打磨“锡纸”的目的是。
②下列可以替代氯化锌溶液完成上述实验的是(填字母)。
A.氯化铜溶液 B.硝酸银溶液 C.硫酸钠溶液 D.硫酸亚铁溶液
【查阅资料】
①常见铁的氧化物有关信息如表:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色粉末 |
能否被磁铁吸引 | 否 | 否 | 能 |
②铁的氧化物不与硫酸铜溶液反应
取一定量铁粉与湿棉花(棉花成分不参加反应)于装置A中。按如图实验,观察到C管口有淡蓝色火焰,烧杯内壁有水雾,说明铁与水蒸气反应产生气体是。
