|
|
A.陶屋 | B.白玉镂雕 |
|
|
C.龙耳锡底铜簋 | D.广彩人物瓷盖盅 |
选项 | 应用实例 | 化学知识 |
A | 利用聚苯乙烯制作泡沫包装材料 | 聚苯乙烯燃烧生成 |
B | 用 |
|
C | 将液态植物油制成人造奶油 | 液态植物油能与 |
D | 从海带灰中提取碘单质 | 海带灰中的 |
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 淀粉水解产生果糖 | 米饭在口腔中越嚼越甜 |
B |
| 加热可除去 |
C | Zn的金属性比Fe强 | 在钢制船壳上镶嵌锌块能减缓船体的腐蚀 |
D |
| 工业上电解熔融 |
选项 | 猜想 | 实验方案 | 验证猜想成立的现象 |
A | 苯酚能与 | 向苯酚浊液中加入适量 | 苯酚浊液变澄清 |
B | 某溶液中一定含有 | 取少量该溶液,先滴加少量 | 产生白色沉淀且沉淀不溶于稀盐酸 |
C | 加热条件下 | 将灼热的铜丝插入无水乙醇中 | 铜丝由红色变成黑色 |
D | 浓 | 向滴有酚酞的NaOH溶液中加入浓 | 溶液红色褪去 |
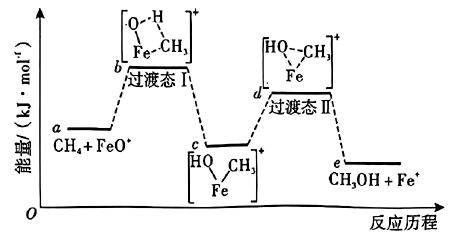
说明:过渡态中“--”表示化学键未完全断裂或形成。

①配制100mL一定浓度的溶液需用到的仪器有(填字母)。

②配制溶液时,需要将
固体溶解在浓盐酸中,原因为。
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液的体积为20.00mL,已知:
, 则该
溶液的浓度为
。
预测现象1:向溶液中加入
溶液,溶液由黄色变为浅绿色。作出该预测的原因为(用离子方程式表示)。
预测现象2:向溶液中加入
溶液,生成红褐色沉淀。
序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 20 | |
0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 | |
38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 | |
现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
①请补充表格中的数据:a=。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是。
③实验ⅵ和ⅶ的实验现象说明溶液中的水解与
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:。
④甲同学认为实验ⅵ和ⅶ中,与
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(填实验操作与现象),则说明猜想成立。
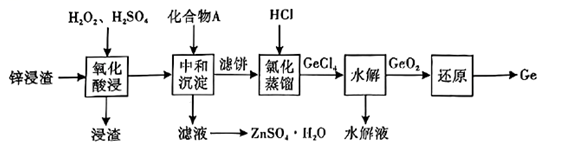
已知:①锗在硫酸中的存在形式:pH≤2.0时主要为 ,
时主要为
。
②常温下, ,
。
请回答下列问题:
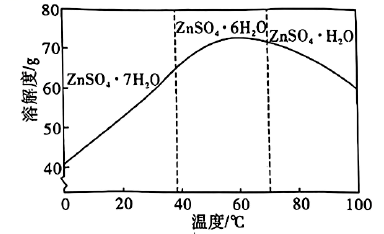
②用惰性电极电解溶液可制取金属锌,电解后的溶液可在上述流程中工序循环使用。
ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。
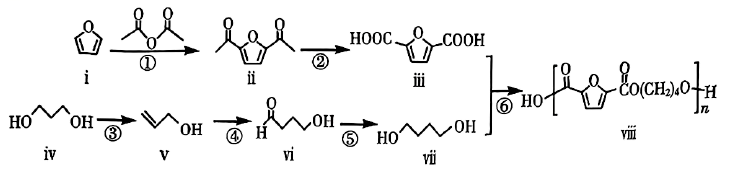
序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
a | 取代反应 | ||
b | 银氨溶液,加热 |
(a)利用反应④的原理得到的产物的结构简式为。
(b)相关步骤涉及卤代烃的水解反应,其化学方程式为(注明反应的条件)。