A | B | C | D |
|
|
|
|
制备并收集少量 NO2 | 吸收尾气 Cl2 | 配制 NaCl溶液 | 制备Fe(OH)2 |
选项 | 物质(括号内为杂质) | 除杂试剂 |
A | 蒸馏水、碱石灰 | |
B | 盐酸、 | |
C |
| |
D |
| 酸性 |

选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 | 右边试管产生气泡较快 |
结论 | 氧化性: | 溶解度:AgCl>AgBr>AgI | 非金属性:C>Si | 催化活性: |

已知:碳热还原过程中可能发生下列反应。
i.
ii.
iii.
下列关于碳热还原过程的说法正确的是( )


已知:常温下,酚酞的变色范围是pH 8.2~10.0,甲基橙的变色范围是pH 3.1~4.4。
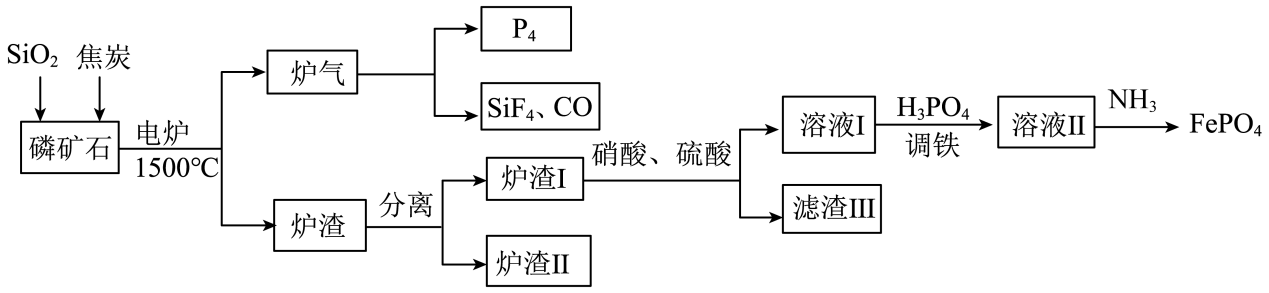
已知:①FePO4可溶于pH<2的酸性溶液。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
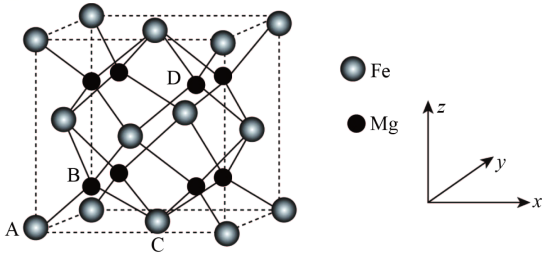
其中A的原子坐标参数为(0,0,0), B为( ,
,
),C为(
,
, 0),则D点的坐标参数为。此晶胞中Fe的配位数是。

总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=kJ·mol-1;该总反应的决速步是反应(填“①”或“②”)

①表示N2O的转化率随的变化曲线为曲线(填“I”或“Ⅱ”);
②T1T2(填“>”或“<”);
③已知:该反应的标准平衡常数 , 其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=(列出计算式)。

已知:①不溶于水,密度比水的大;
②不溶于
;
③三颈烧瓶内盛放有、水和催化剂。
回答下列问题:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是。
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应该反应比较缓慢),当看到现象时说明该反应接近完全。
①熄灭A处的酒精灯,关闭 , 移开水浴,将装置D继续加热至105℃,当
完全分解后(
),打开
, 继续保持液温105℃,缓缓滴入适量的
溶液,发生反应的化学方程式为。
②装置E中多孔球泡的作用是。
①滴定时发生的反应:(白色)。则判断到达滴定终点的方法是。
②晶体中的质量分数为(结果精确至0.1%)。

①含有苯环,苯环上有三个取代基,其中氨基只与苯环直接相连;
②与氯化铁溶液反应显紫色,与NaHCO3溶液反应有气体产生。
①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
 (R代表烃基,R'代表烃基或H)。请写出以
(R代表烃基,R'代表烃基或H)。请写出以