 B .
B . A | 在纯金属中加入其他元素形成合金 | 改变了金属原子有规则的层状排列,硬度变大 |
B | 石墨通过化学剥离法制得石墨烯 | 石墨烯的导电性、导热性更好 |
C | 在涤纶纤维中混纺天然纤维 | 增强了透气性和吸湿性 |
D | 顺丁橡胶硫化 | 硫化程度越高,强度越大,弹性越好 |

| 实验目的 | 方案设计 | 现象 | 结论 |
A | 探究温度对 |
| ①浸泡在热水中的烧瓶内红棕色加深 ②浸泡在冷水中的烧瓶内红棕色变浅 | ①升高温度, ②降低温度, |
B | 验证 |
|
|
|
C | 检验 |
| 溴水褪色 |
|
D | 探究 |
| 圆底烧瓶中形成喷泉,溶液显红色 | 氨气极易溶于水,氨水显碱性 |
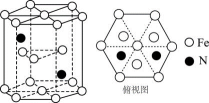


图1
反应II:
反应Ш:
反应过程中、
浓度随反应时间的变化关系如下表所示:其中反应至
时
达到过程中的最大值。
浓度 时间 | ||
0 | 0 | 0 |
0.22 | 0.02 | |
0.70 | 0.16 | |
0.35 | 0.58 | |
0.20 | 0.76 |

图2
2 计算该温度下反应II的平衡常数。
②图2为不加盐酸时的浓度随时间变化图,若其它条件不变,反应起始时溶液中含有盐酸,在图2中画出
的浓度随时间变化。
用分析天平(称量产品)
用烧杯
用(配制
的溶液
)
用移液管
在中
用(盛装
溶液滴定
, 消耗
)
仪器:a.烧杯;b.滴定管;c.容量瓶;d.锥形瓶
操作:e.加水溶解;f.加盐酸溶解;g.加入三乙醇胺、和钙指示剂;h.量取
溶液
①含有苯环和硝基;
②谱显示有四组峰,峰面积之比为
。