液体 | 血浆 | 胰液 | 胃液 | 胆汁 |
pH | 7.35-7.45 | 7.5-8.0 | 0.9-1.5 | 7.1-7.3 |
 B . 添加试剂
B . 添加试剂 C . 闻气味
C . 闻气味 D . 称量氢氧化钠固体
D . 称量氢氧化钠固体

选项 | 溶液 | 杂质 | 试剂和方法 |
A | 滴入足量稀盐酸至不再产生气泡 | ||
B | 滴入适量 | ||
C | 加入过量的 | ||
D | 滴入过量 |
![]()
PH | <6.5 | 7.0~7.1 | 7.5~8.5 | 8.5~12.0 | >12.5 |
颜色 | 粉红色 | 紫色 | 蓝色 | 绿色 | 黄色 |

①甲:NaOH固体 乙:水 ②甲:CO2 乙:NaOH溶液
③甲:生石灰 乙:水 ④甲:水 乙:浓硫酸
①2H2O2=2H2O+O2↑ ②2CaO2+2H2O=2Ca(OH)2+O2↑
③2CaO2+2CO2=2CaCO3↓+O2 ④2Na2O2+2H2O=4NaOH+O2↑
⑤2Na2O2+2CO2=2Na2CO3+O2 ⑥KClO3不与H2O、CO2反应
在鱼苗长途运输中最适合加入的物质是( )
 B .
B .  C .
C .  D .
D . 
①生石灰 ②氢氧化钠 ③熟石灰 ④氢氧化铝 ⑤浓硫酸
![]()
①不锈钢 ②金刚石 ③氧化铁 ④黄铜 ⑤活性炭




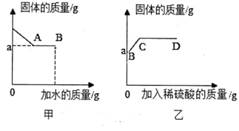
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图甲所示;
Ⅱ.取少量B点的清液于试管中,滴加酚酞试液,试液不变色;
Ⅲ.继续向烧杯中滴加稀硫酸并不断搅拌,烧杯内固体的质量随加入稀硫酸的质量的变化如图乙所示。请回答下列问题:
pH变化曲线如图所示:

①该反应的化学方程式是;
②该实验操作是将(写溶质的化学式)溶液逐滴加入到另一种溶液中。
【提出问题】此时烧杯中的溶质成分是什么?
【猜想与假设】Ⅰ:Na2SO4 Ⅱ: Ⅲ:Na2SO4和NaOH
【实验与探究】
实验步骤 | 实验现象 | 实验结论 |
取少量上述烧杯中的溶液于试管中, 滴加溶液 | 猜想Ⅱ正确 |
【实验设计】

【实验过程】主要步骤如下,请填空:
①按图组装仪器,并检查装置气密性。
②将10g试样放入B瓶中,加适量蒸馏水溶解,得到试样溶液;
③打开弹簧夹a,先对装置A、B、C(已连接)通入空气一会儿,以排尽装置含有的,再关闭弹簧夹a,接上装置D和E,打开弹簧夹c;
④从分液漏斗中滴入20%的稀硫酸,直到不再产生气泡为止;
⑤反应结束后,待装置冷却后直接称量装置(填字母序号)质量。
【数据分析】
⑥根据该装置在反应前后的质量差得到CO2的质量,由此计算出该样品中碳酸钠的质量,最后得到样品中氢氧化钠纯度;
【实验反思】⑦E装置的作用是。
⑧最后计算得到样品中氢氧化钠纯度比实际数据偏大,反思整个实验过程,造成误差可能的原因:。


实验1:小乐在试管中放入一枚未打磨的铝片,然后注入适量pH=4的稀盐酸。铝片与稀盐酸反应产生氢气的速率随时间变化的图线如图甲所示。
猜想1:盐酸中的氯离子对反应起促进作用;猜想2:硫酸中的硫酸根离子对反应起阻碍作用。
为了验证猜想,小乐设计了如图乙所示实验。
加入的两种固体物质A和B分别是、。

方案一:利用如图甲所示装置,分别将相同质量的两种待检药品与足量稀硫酸反应,并用电子天平测得产生二氧化碳的质量,其质量如表所示。
方案二:利用如图乙所示装置,分别将相同质量的两种待检药品与足量稀硫酸反应,并用量筒测出排出水的体积,其体积值如表所示。(常温常压下二氧化碳的密度约为3克/升)
待检药品 | 二氧化碳的质量 | 待检药品 | 排出水的体积 | |
m克X | 0.4克 | m克X | 0.22升 | |
m克Y | 0.3克 | m克Y | 0.17升 |
【收集资料】通过阅读标签及查阅资料,她获得如下信息:
①该固体酒精中含有酒精、氯化钙、氢氧化钠三种物质;
②酒精的化学式为C2H5OH;
③氯化钙、氯化钡的水溶液均呈中性。
【提出问题】酒精的化学式与NaOH相比,都有“OH”,那么酒精的水溶液是不是显碱性?
固体酒精中的氢氧化钠是否变质及变质的程度如何?
【实验探究】实验一:她取少量酒精溶液于试管中,滴加硫酸铜溶液,未观察到蓝色沉淀,说明酒精溶液(填“显”或“不显”)碱性。
实验二:她先取少量固体酒精于烧杯中,加入足量水溶解后静置,发现烧杯底部有白色沉淀,再取沉淀于试管中加稀盐酸,观察到有气泡,说明氢氧化钠已变质。请写出氢氧化钠在空气中变质的化学方程式。
她取上述烧杯中上层清液于试管中,先滴加足量澄清石灰水,发现生成白色沉淀,再滴入几滴无色酚酞溶液,液体呈红色,她认为氢氧化钠部分变质。老师发现后,提示她由该实验得出的结论不可靠。你认为只要将上述实验中的澄清石灰水变为(填化学式)溶液,即可得到氢氧化钠部分变质的结论。
Ⅰ.碳减排:减少人类生产和生活中二氧化碳的排放量。

用该技术进行“碳捕获”有效利用了原材料,该过程中被循环利用的物质是。

①a的值是;
②求反应后溶液中溶质的质量分数。(写出计算过程)
| 加入稀硫酸的质量/g | 充分反应后剩余固体的质量/g |
第1次 | 40 | m |
第2次 | 40 | 14.8 |
第3次 | 40 | 12.2 |
第4次 | 40 | 11.2 |
第5次 | 40 | 11.2 |

