 B . 点燃酒精灯
B . 点燃酒精灯 C . 稀释浓硫酸
C . 稀释浓硫酸 D . 测溶液pH
D . 测溶液pH

序号 | 出库凭证号 | 77011-01 | ||
出库日期 | 领用前质量(克) | 领用后质量(克) | 教学使用质量(克) | |
1 | 2021.09.13 | 448.5 | 448.4 | 0.1 |
2 | 2023.09.07 | 443.0 | 443.0 | 0 |
3 | 2024.03.06 | 4425 | 325 | 116.5 |
 向稀硫酸和硫酸铁的混合溶液中滴加氢氧化钠溶液直至过量
B .
向稀硫酸和硫酸铁的混合溶液中滴加氢氧化钠溶液直至过量
B . 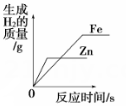 相同质量的铁和锌分别与质量分数相同的足量稀盐酸反应
C .
相同质量的铁和锌分别与质量分数相同的足量稀盐酸反应
C . 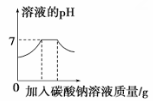 向一定量氯化钡与盐酸的混合溶液中逐滴加入碳酸钠溶液至过量
D .
向一定量氯化钡与盐酸的混合溶液中逐滴加入碳酸钠溶液至过量
D . 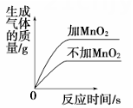 用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2


 B .
B .  C .
C .  D .
D . 

选项 | 实验目的 | 实验方案 |
A | 鉴别稀盐酸和稀硫酸溶液 | 加入硝酸银溶液,观察现象 |
B | 检验氢氧化钠溶液变质程度 | 先加过量的氯化钡溶液,过滤后向滤液中加入酚酞 |
C | 除去二氧化碳中混有的氯化氢 | 将气体通过足量的氢氧化钠溶液 |
D | 除去 | 加水溶解、蒸发结晶 |



。X的化学式是。


【已知氢气与氧化铜(或氧化铁)在加热的条件下,会发生反应,生成金属铜单质(或金属铁单质)和水】

波义耳实验:在密闭的曲颈瓶中加热金属汞时,得到了金属灰(氧化汞)。冷却后打开容器,称量金属灰的质量,发现比原来金属质量增加了。 | 罗蒙诺索夫重做了波义耳实验,他将金属铅装入容器后密封,称量。然后把容器放到火上加热,金属变成了黄色(氧化铅),冷却后再次称量,发现容器的总质量没有发生变化,该发现当时未引起科学家的注意。 | 拉瓦锡用锡和铅做了罗蒙诺索夫实验,也得到了同样的结论。他还做了许多实验并得出结论:在化学反应过程中物质质量是守恒的,并将此结论写成一个代数式。该结论得到当时科学家的普遍认同。 | 廊道尔特和曼莱做了精确度极高的化学实验,反应前后质量之差小于0.0001g,在实验误差范围内,国际科学家一致承认质量守恒定律。 |
1673年 | 1756年 | 1774年 | 1908年、1912年 |

受上述研究启发,小丽对相关实验进行了深入探究。

【提出问题】滴加碳酸钠溶液后,试管中溶液的溶质成分中含有哪些离子?
【猜想与假设】小南同学猜想是:Na'、OH:小岗同学猜想是:Na'、OH、。
小岗同学进行了自己的验证实验,取试管中溶液少许于另一试管中,向其中滴加稀硫酸,观察到有气泡产生的现象,于是得出结论:自己的猜想是错误的:
小南同学为了验证自己的猜想,取试管中溶液少许于另一试管中,向其中滴加少量硫酸钠溶液,没有观察到明显的实验现象,于是得出结论:自己的猜想正确。请对小南同学的实验得出的结论进行评价;
小南、小岗两位同学的实验所选用的试剂不同,得出结论也不相同,由两位同学的验证实验总结得出:在验证猜想的溶液中溶质离子成分时,所选试剂要求是,
就能一次性验证溶质离子成分:
【实验设计】小科设计了如图所示的装置进行实验(部分夹持装置未画出)。

【实验步骤】①按图连接好仪器,并检查装置气密性:
②在U形管B中放入若干钙片样品,样品总质量 , 通过A往装置中通入氮气:
,
③一段时间后,测得C装置质量为;
④打开分液漏斗活塞,加入稀盐酸,至B装置不再产生气泡;
⑤再次通入氮气,一段时间后,测得C装置质量。
【实验分析】

①加入过量的氢氧化钡溶液后所得的固体沉淀是。
②加入过量的碳酸钠溶液的作用是。
项目 | 实验步骤 | 实验现象 | 实验结论 |
方案 | ①取少量废水于试管中,滴入几滴紫色石蕊试液 | 紫色石蕊试液变红色 | 不含 |
②另取少量废液于试管中,滴加过量的 | 产生白色沉淀 | 含有 | |
③取步骤②的上层清液于试管中,滴加几滴。 | 产生白色沉淀 |
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
试回答:
加入稀硫酸质量/g | 20 | 40 | 60 | 80 |
产生气体质量/g | 0 | 0.2 | 0.4 | 0.5 |




烧杯1 | 烧杯2 | 烧杯3 | |
样品溶液/g | 10 | 20 | 30 |
氯化钙溶液/g | 50 | 50 | 50 |
沉淀质量/g | 3 | 6 | 7.5 |
如上表所示,哪几个烧杯内样品中的纯碱完全反应。