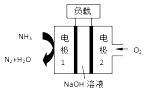

请回答下列问题:
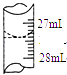
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字).
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L﹣1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
① | 25.00 | 0.00 | 26.29 |
② | 25.00 | 1.00 | 31.00 |
③ | 25.00 | 1.00 | 27.31 |
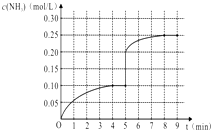
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
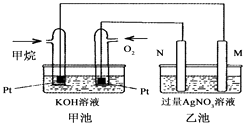
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka