 B .
B .  C .
C .  D .
D . 




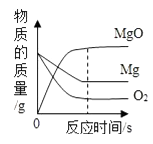 镁在氧气中燃烧
B .
镁在氧气中燃烧
B . 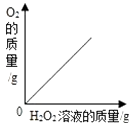 向二氧化锰中加入过氧化氢溶液
C .
向二氧化锰中加入过氧化氢溶液
C . 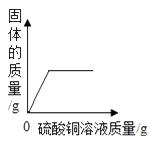 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D .
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D . 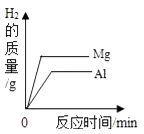 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
a.石墨 b.氯化钠 c.干冰 d.明矾 e.盐酸 f.氮气
①用于净水 ②用于生产铅笔芯
③用于金属表面除锈 ④用作粮食保护气
⑤用于人工降雨 ⑥用作厨房调味剂
① 硫酸铜溶液与氢氧化钠溶液反应,产生沉淀
② 实验室制氢气,此反应属于(填基本反应类型)
③ 曾青得铁则化为铜,实验现象
④ 镁带在空气中燃烧,实验中用(填仪器名称)夹持镁条

a.降低着火点 b.增大与可燃物接触面积 c.与空气中气体反应生成 CO2

A.水 B.过氧化氢 C.氯化钾 D.高锰酸钾
A.颜色 B.可燃性 C.溶解性 D.密度

请推测以下装置的作用:I、J.
久置的铜制品表面能生成 Cu2(OH)2CO3 . 甲组同学以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:

【查阅资料】Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
【分析评价】
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。

【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
① C O还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关
② CO还原Fe2O3的实验过程中固体产物可能有Fe3 O4、FeO、Fe
③ NaOH溶液与石灰水相似,能吸收CO2 , 但不变浑浊
④
物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验与猜想】
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)。
一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
实验装置图中采用虚线框内的装置,其作用有 。

上述反应产生CO2的质量为g;