①碱式滴定管用蒸馏水洗净后未用标准溶液润洗 ②锥形瓶中盛有少量蒸馏水,再加待测液 ③酸式滴定管用蒸馏水洗净后,未用盐酸润洗 ④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 ⑤滴定后观察碱式滴定管读数时,俯视刻度线.
 B .
B . 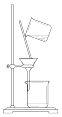 C .
C .  D .
D . 
选项 | 操作和现象 | 结论 |
A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4 , 振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
 制备氨气
B .
制备氨气
B . 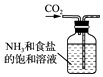 制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D .  灼烧NaHCO3
灼烧NaHCO3
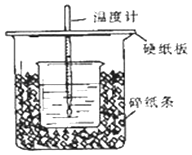
通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称,另一处错误是.
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择mol•L﹣1的溶液进行实验.大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”).
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会;(填“偏大、偏小、无影响”) 如果用60mL0.50mol/L盐酸与50mL0.55mol/L的NaOH溶液所求中和热(填“相等、不相等”).
请回答下列问题:
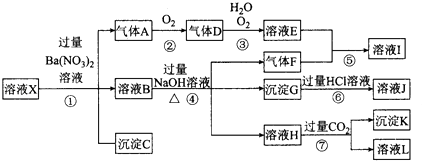
a.一定有 b.一定没有 c.可能有
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol • L-1 FeCl3溶液 |

A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来