成语 | 化学原理 | |
A | 炉火纯青 | 通过观察火焰的颜色来判断炉内的温度 |
B | 刀耕火耨 | 放火烧去野草,用余灰可以肥田,还可以降低土壤碱性 |
C | 百炼成钢 | 通过多次锻炼,使生铁中碳等杂质降低达到了钢的标准 |
D | 青出于蓝而胜于蓝 | 蓝色的靛蓝染料发生化学反应生成一种深蓝色的新染料 |
 向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
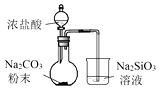 验证H2CO3酸性强于H2SiO3
B .
验证H2CO3酸性强于H2SiO3
B . 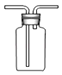 收集CO2或NH3
C .
收集CO2或NH3
C . 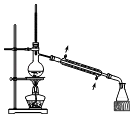 分离Na2CO3溶液与CH3COOC2H5
D .
分离Na2CO3溶液与CH3COOC2H5
D . 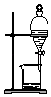 分离CH3CH2OH与CH3COOC2H5
分离CH3CH2OH与CH3COOC2H5
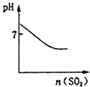 可表示将SO2气体通入溴水时pH的变化
B .
可表示将SO2气体通入溴水时pH的变化
B .  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .  表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .  表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 浓硝酸 | Cu | NO2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
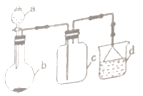
物质 | X | Y | Z |
初始浓度/mol•L﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/mol•L﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
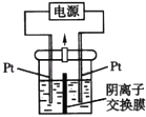
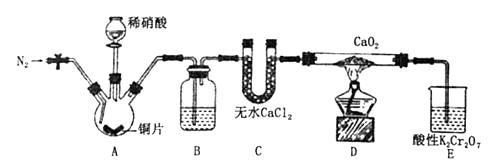
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2 .
请回答下列问题:
a.向装置中通入N2 b.向三颈烧瓶中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入氮气 f.关闭分液漏斗旋塞
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化、滴定
在碘量瓶中将因氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+(该反应放热),在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2═2I﹣+S4O
)
回答下列问题:
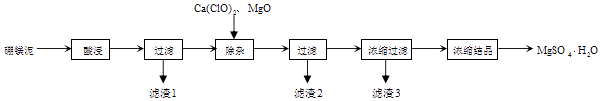
硼镁泥的主要成分如表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
资料:B2O3溶于水形成硼酸,由于硼酸易溶于水,溶解度随温度的升高而升高,而硫酸镁在80℃溶解度最大,所以常规方法很难将二者分离,目前常采用高温结晶法
回答下列问题:
A.取上层清液,滴加苯酚试液不显紫色
B.取上层清液,滴加KSCN,不变红
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀