 酿酒
B .
酿酒
B .  织布
C .
织布
C .  火药应用
D .
火药应用
D .  瓷器烧制
瓷器烧制
 闻气味
B .
闻气味
B . 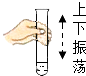 振荡试管
C .
振荡试管
C . 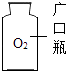 贮存气体
D .
贮存气体
D . 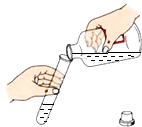 倾倒液体
倾倒液体

序号 | 甲 | 乙 |
A | CuSO4溶液 | 铁粉 |
B | H2SO4溶液 | 锌粒 |
C | HCl溶液 | NaOH溶液 |
D | CaCl2溶液 | Na2CO3溶液 |
A.瓷碗易碎 B.轮胎能炸 C.饭菜会馊 D.
A.煤 B. 石油 C.风能 D.

A.氢氧化钠 B.碳酸钙
C.硝酸铵 D.
A.由C,H,O三种元素组成 B.属于氧化物
C.相对分子质量为282g D.其中质量分数最大的元素是(填元素名称)

A.t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液
B. t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙
C. t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和
D. t2℃时,甲、乙饱和溶液的溶质质量分数都为
①打井取用地下水,检验地下水是否为硬水可用,生活中降低水的硬度的方法是;
②取用浑浊的河水,加入明矾处理后,再用活性炭除去水中的异味和色素。其中利用了活性炭的性;
③干旱地区容易发生火灾。消防员利用高压水枪灭火的原理是。
①图1是铝在元素周期表中的信息以及原子结构示意图。铝元素的相对原子质量为 ;

②图2中的四种粒子的化学性质与铝原子相似的是(填字母,下同),它们表示的元素与铝元素同一周期的是;
③工业上用电解熔融的方法冶炼铝,化学方程式为:2X 4Al + 3O2↑,则X的化学式为。
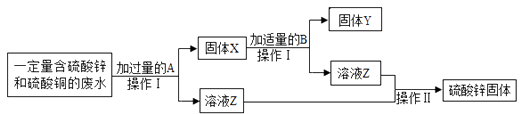

请回答:
利用表中装置进行下列实验。已知:白磷的着火点为40℃。
| 实验装置 | 实验1 | 实验2 |
 | I.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞 II.打开K,从长颈漏斗向瓶内加入稀盐酸,至浸没锌粒 II.当瓶中产生大量气泡时,关闭K | I.将盛有白磷的燃烧匙伸入瓶内,塞紧瓶塞 II.打开K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷 III.从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K |


反应后溶液的溶质有哪些?
【查阅资料】①碳酸钠和稀盐酸反应生成物受到盐酸的质
量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
【猜想与假设】实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl;
③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是。
实验步骤 | 实验现象 | 实验结论 |
A、取上述溶液少量于试管中,加 入足量的溶液。 | 产生白色沉淀 | 猜想①正确 |
B、取步骤A所得上层清液少量,滴加 溶液。 |