 制取NO2
B .
制取NO2
B .  净化NO2
C .
净化NO2
C .  收集NO2
D .
收集NO2
D .  尾气处理
尾气处理
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1

选项 | 实验操作和现象 | 实验结论 |
A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO3- |
B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
C | 氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀 | 氯乙烷发生水解 |
D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |

容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |


①电解过程中,加入氯化钙的目的是。
②石墨电极发生的电极反应方程式为。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为。
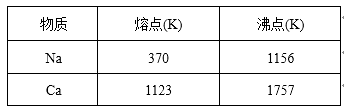
已知部分物质的熔沸点如下表:

①含有苯环,且遇FeCl3溶液不显色;
②能发生水解反应,水解产物之一能发生银镜反应,另一水解产物分子中只有3种不同化学环境的氢。
 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。


①过硫酸铵与Mn2+反应生成MnO2的离子方程式为。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是。


图2 图3
①吸收初期(图中A点以前)反应的化学方程式为。
②C点高于B点的原因是。
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:

步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照右图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题: