 B .
B .  C .
C .  D .
D . 

选项 | 实验操作 | 实验现象 | 结论或解释 |
A | 用镊子夹取一块金属钠并用滤纸吸干表面的煤油,用小刀切开一端的外皮 | 切口处呈银白色,很快变暗 | 常温下,钠与O2反应生成了Na2O2 |
B | 用坩埚钳夹住一块表面用砂纸打磨过的铝箔在酒精灯上加热一会儿 | 铝箔熔化,但并不滴落 | 铝的熔点比Al2O3更高 |
C | 做焰色反应实验时,某同学用洁净的铂丝蘸取样品在无色火焰上灼烧 | 直接观察到火焰的颜色呈黄色 | 该样品中含有钠元素,一定不含钾元素 |
D | 在两支试管中分别加入等物质的量浓度的Na2CO3和NaHCO3溶液,然后各滴加2滴酚酞 | 溶液均变成红色,但Na2CO3溶液颜色更深一些 | 同浓度的Na2CO3溶液碱性更强 |
①
④
②
③
Al2O3︰
Fe2O3︰
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序是。
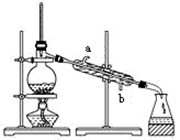
某化学兴趣小组同学利用该研究结论,采用西红柿(或洋葱)作为供水剂,设计了如图装置进行实验,并对铁与水蒸气反应的产物进行检验。

回答下列问题:

①加入稀硫酸发生的离子方程式为。
②试剂A是(选填字母),现象2为。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是。