 B . 黄豆酿酱油
B . 黄豆酿酱油  C . 糯米酿甜酒
C . 糯米酿甜酒  D . 鲜奶制酸奶
D . 鲜奶制酸奶 
 B .
B .  C .
C .  D .
D .  )广泛用于造纸、制革、化工,四川储量丰富,其化学式为:KAl3(SO4)2(OH)x . 式中x的值是( )
)广泛用于造纸、制革、化工,四川储量丰富,其化学式为:KAl3(SO4)2(OH)x . 式中x的值是( )
物质 | 区别的方法或试剂 | |
A | 矿泉水和蒸馏水 | 加肥皂水搅拌 |
B | 空气和呼出气体 | 澄清石灰水 |
C | 氮气和二氧化碳 | 燃着的木条 |
D | 高锰酸钾和二氧化锰 | 观察颜色 |
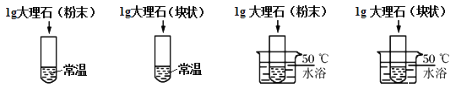
下列对比实验的设计不合理的是( )
选项 | 对比实验 | 探究影响因素 |
A | ①和② | 反应物的接触面积 |
B | ②和③ | 温度 |
C | ②和④ | 温度 |
D | ③和④ | 反应物的接触面 |
①质子数:氯离子氯原子;
②沸点:N2O2;
③金属与稀盐酸反应的剧烈程度:镁铁;
④20℃,1.0g硫粉在2.0g氧气中完全燃烧后生成的二氧化硫的质量3.0g;
⑤若用KClO3和MnO2(催化剂)混合制取氧气,则MnO2在反应前后固体混合物中的质量分数:反应前反应后。

一段时间后,混有炭粉的铁粉包 (填“上升”、“下降”“不动”),原因是。
①天平 ②胶头滴管 ③漏斗 ④量筒 ⑤烧杯 ⑥玻璃棒

①20℃时,KNO3的溶解度(S)=;⑤是 (填“饱和”或“不饱和”)溶液。
②40℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1w2 (填“>”、“=”或“<”)。
③小明发现:升温至40℃,②→③的过程中有少量水蒸发。下列叙述正确的是 (填序号)
A.①、②均为不饱和溶液
B.②中溶质与溶剂的质量比为40:100
C.②→③的过程中溶质质量分数变大
D.④→⑤的过程中析出KNO3晶体32.3g
④除去KNO3固体中混有的少量NaCl的实验操作是:加适量水溶解→加热得到热饱和溶液→→过滤→洗涤→干燥→KNO3晶体。

①“11”指的是。
②钠原子在化学反应中易失去1个电子,形成(填离子符号)。
序号 | 物质 | 温度 | 平均速率/(m•s﹣1) |
A | H2 | 27℃ | 1900 |
B | O2 | 27℃ | 480 |
C | O2 | 127℃ | 560 |
①在A,B和C中,能比较得出“温度越高,分子运动速率越快”的是(填序号)。
②从图中可见,影响分子运动速率的因素除温度外,还与有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:。
①若选用装置B为发生装置,则反应化学方程式为。
②若用D装置来收集生成的氢气,气体应从 (填a或b)通入。
实验室里若用双氧水和二氧化锰反应制氧气,该实验 (填“能”或“不能”)选用C装置来达到上述优点。

2H2O+2Na2O2=+O2。

同学们在老师的指导下,设计了上述装置进行实验(夹持装置略),并实验记录:
实验操作 | 主要实验现象 | 实验结论及解释 |
①检查装置的气密性 | ∕ | 装置气密性良好 |
②向装置A中加入大理石,打开分液漏斗上活塞,缓慢滴入稀盐酸 | 装置A中观察到的现象有;装置C装置中有气泡出现 | 装置A中发生反应的化学方程式为;装置C作用是 |
③一段时间后用带火星的木条在装置C的右侧导管口 | 带火星的木条复燃 | 过氧化钠与二氧化碳反应并生成氧气 |
【实验结论】过氧化钠能与人体呼出的水蒸气、二氧化碳分别反应生成氧气。
某同学对实验二的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是。