实验目的 | 实验操作、现象 | |
A | 除去NaHCO3固体中的Na2CO3 | 将混合物装入试管中,用酒精灯加热至恒重 |
B | 量取20.00mL0.1mol/LKMnO4溶液 | 在25mL碱式滴定管中装入KMnO4溶液,调整初始读数为5.00mL后,将剩余KMnO4溶液放入锥形瓶中 |
C | 证明镁与CO2发生了置换反应 | 用坩埚钳将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 |
D | 判断某溶液中有Na+ , 并且没有K+ | 用洁净的铂丝蘸取溶液在酒精灯的外焰上灼烧,观察到火焰呈黄色 |

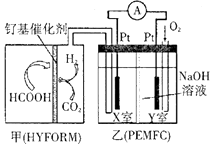

①其中A装置中的固体变为红棕色,则固体产物中含有;C装置中红色褪去,说明气体产物中含有。
②为验证A中残留物是否含有FeO,需要选的试剂有。
A.KSCN溶液
B.浓盐酸
C.KMnO4溶液
D.稀硫酸
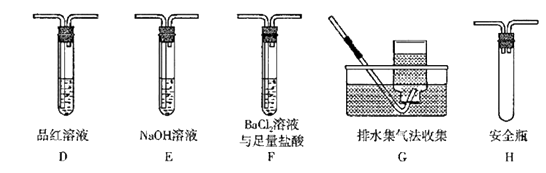
①丁同学的实验中,装置依次连接的合理顺序为A、。
②装置F中,足量盐酸的作用是。
S(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式。
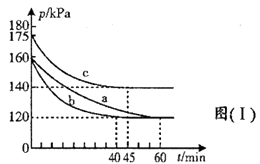
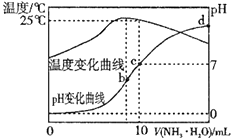
①图(Ⅰ)中三组实验从反应开始至达到平衡时,v(CO)最大的为(填序号)
②与实验a相比,c组改变的实验条件可能是。
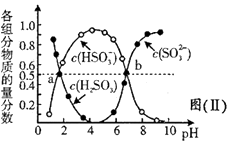
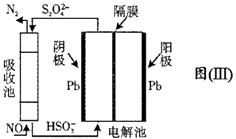
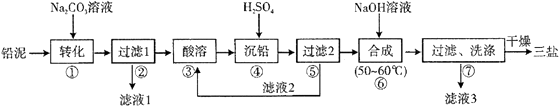
已知:Ksp(PbSO4)=1.82×10-8 , Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。请回答下列问题:

①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为形,写出一个ClO3-的等电子体的化学符号。
③已知高碘酸有两种形式,化学式分别为H5IO6( 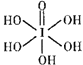 )和HIO4 , 前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6HIO4(填“>”“<”或“= ”)
)和HIO4 , 前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6HIO4(填“>”“<”或“= ”)
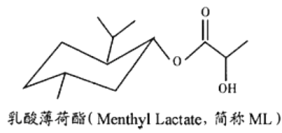
(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰