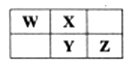
选项 | 甲 | 乙 | 丙 | 实验结论 |
|
A | 苯、液溴 | 铁粉 | AgNO3溶液 | 苯与溴发生取代反应 | |
B | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
C | 浓盐酸 | KMnO4 | 品红溶液 | Cl2具有漂白性 | |
D | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 |
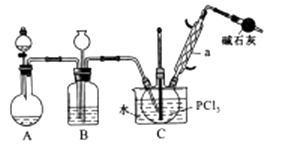
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填标号),滴定终点的现象为。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式)。
③步骤III加入硝基苯的目的是,如无此操作,所测Cl元素含量将会(填“偏大”“偏小”或“不变”)。
① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= 。
反应温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64 | 50.7 | 42.9 |
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。
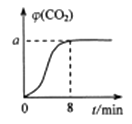
①前 8minCO 的反应速率为;平衡时a=。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2 , 平衡移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是(填标号)。
A.增大Fe2O3用量
B.增大压强
C.降低温度
D.向容器中再充入少量CO
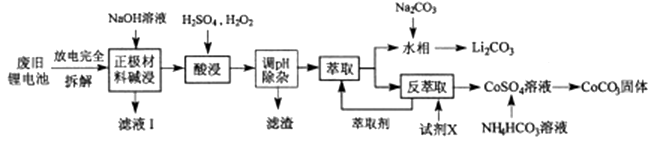
几种金属离子沉淀完全(离子浓度为10-5mo/L) 的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
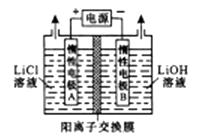
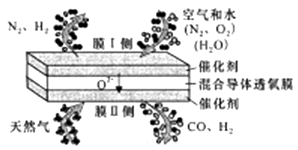
①电解槽中阳极的电极反应式是。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为。
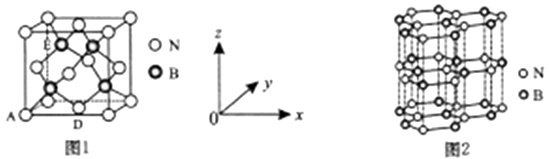
①晶胞中的原子坐标参数可表亓晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为( ),则E原子的坐标参数为。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N 与B的原子半径之和为pm。(
)
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3 , 则层与层之间距离的计算表达式为pm。
a.能发生银镜反应
b.含 有—C≡CH 结 构
c.无—C≡C—O—结构
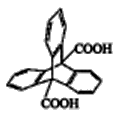
写出其中核磁共振氢谱峰面积比为1:2:2:1的一种有机物的结构简式。
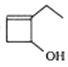 的合成略线(其他试剂任选)。
的合成略线(其他试剂任选)。