选项 | 实验 | 预期现象 | 预期结论 |
A | 将SO2气体通入Ba(NO3)2溶液中 | 有白色沉淀生成 | H2SO3与Ba(NO3)2发生复分解反应生成BaSO3 |
B | 向盛有KI溶液的试管中,滴加少量新制氯水和CCl4 , 振荡、静置 | 下层溶液显紫色 | Cl2氧化性比I2强 |
C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体 | 溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率,起到了催化剂的作用 |
D | 向FeCl3饱和溶液中逐滴滴入足量浓氨水,并加热至沸腾 | 生成红褐色透明液体 | 得到Fe(OH)3胶体 |
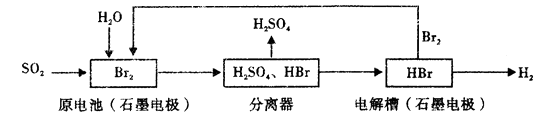

②证明有SO2 生成的现象是;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4 , 请写出装置B处反应的化学方程式。
①第一支试管中加入1mLCCl4 , 充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为。
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式,该热化学方程式的平衡常数K=(用K1、K2、K3表示)。
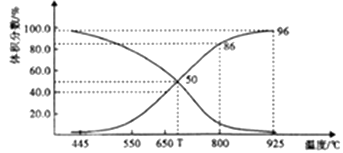
①T℃时,在容器中若充入稀有气体,v(正)v(逆)(填“>”“<”或“="),平衡移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡移动。
②CO体积分数为40%时,CO2 的转化率为。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为;925℃时,Kp=(用含p总的代数式表示)。
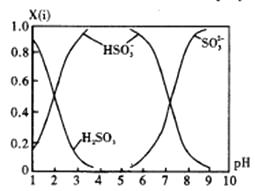
①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因。
![]()
A.HCl溶液
B.H2SO4 溶液
C.氨水
D.NaOH溶液
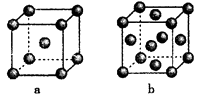
①铁采纳的是a堆积方式.铁原子的配位数为,该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为g·cm-3(用含有r、NA的最简代数式表示)。

已知:
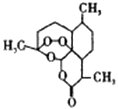
①E的分子式为C9H8O2 , 能使溴的四氯化碳溶液褪色
②H的结构简式为 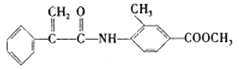
③RCOOH ![]() (R为烃基)
(R为烃基)
④ 
请回答下列问题:
①能发生银镜反应 ②能发生水解反应 ③分子中含的环只有苯环