
已知:在溶液中,FeSO4+NO [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是( )


a.FeSO4溶液
b.浓HNO3溶液
c.酸性KMnO4溶液
d.Na2SO3溶液
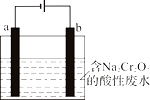
①已知酸性废水中存在Cr2O72-和CrO42-的转化平衡,请用离子方程式表示它们之间的转化反应;
②加入沉淀剂BaCl2溶液之前需加入一定量的NaOH溶液,以利于沉淀的生成,则生成的沉淀为(写化学式)。
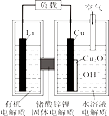
①装置中b电极的材料是(填“铁”或“石墨”)。
②该处理过程中,Cr2O72-被还原成Cr3+的离子方程式为。
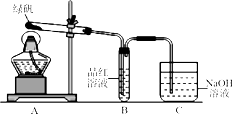
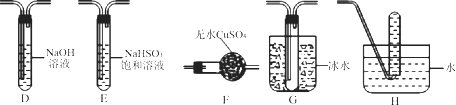
①同学丙的实验装置中,依次连接的合理顺序为。
②能证明绿矾分解产物中有O2的实验操作及现象是。
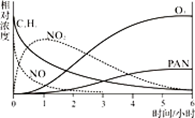
a.NO的消失的速率比CxHy快
b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3
d.O3生成PAN
a.体系压强保持不变
b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗2 mol NO同时生成2 mol NO2
①下图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g) 2NO(g)为(填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2 , 达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为。
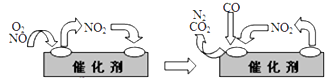
③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2 , 共放出热量867 kJ,则ΔH2=。若用标准状况下4.48 L CH4还原NO2至N2 , 共转移的电子总数为(阿伏加德罗常数的值用NA表示)。
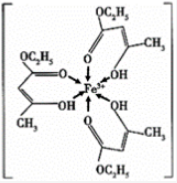
①此配合物中,铁离子价电子排布图为;
②此配离子中碳原子的杂化轨道类型为;
③此配离子中含有的化学键为。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
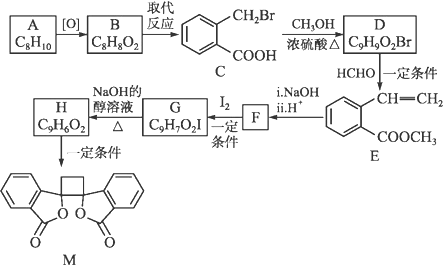
已知:ⅰ.RCH2Br ![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R' ![]()
![]()
ⅲ.R—HC=CH—R'
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH