人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是。
① 以上叙述中不涉及到的材料是(选填序号)。
A.金属材料
B.无机非金属材料
C.有机合成材料
② 我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理。
③ 鉴别黄铜和黄金,以下方法不可行的是(选填序号)。
A.观察颜色
B.加稀盐酸
C.在空气中灼烧
I.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法。
方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色。
①反应中溶液的pH逐渐(填“增大”或“减小”)。
②该反应的化学方程式。
兴趣小组称取此固体12.0g,在科研人员的指导下用下图装置进行热分解实验。
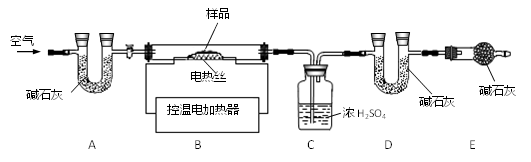
【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物。该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近。装置A的作用是。
|
装置 |
实验前/g |
实验后/g |
|
C |
198.0 |
199.8 |
|
D |
221.0 |
223.2 |
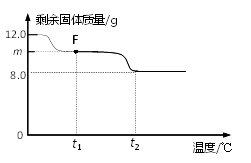
①图中F点对应的m=。
② 根据提供的数据, xCuCO3·yCu(OH)2·zH2O中x﹕y﹕z = 。
③ 若缺少装置E,测得的(选填“x”、“y”、“z”)的值会偏大。