(3)
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO
3、Pd(NO
3)
2、Cu(NO
3)
2、Fe(NO
3)
3、Ni(NO
3)
2、HNO
3等]为原料生产“钯金”,流程如下:
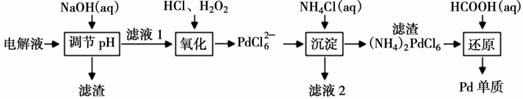
定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=,(Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。

