2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视.过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ•mol﹣1)的变化:
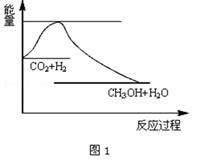

①从反应开始到平衡,CO2的平均反应速率v(CO2)=.
②该反应的平衡常数表达式K= .
③下列措施中能使化学平衡向正反应方向移动的是(填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入1molCO2和3molH2