CO(g)+H2O(g)=CO2(g)+H2(g)△H2。
则反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的△H=(用含△H1、△H2的代数式表示)
化学键 | H=H | O=O | O-H |
E/kJ·mol-1 | 436 | x | 463 |
已知:H2(g)+ O2(g)=H2O(g)△H=-241.8kJ·mol-1 , 则x=。
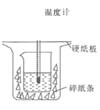
a.大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎纸条
b.用量筒量取盐酸时仰视刻度
c.NaOH溶液过量
d.将NaOH溶液分多次倒入盛有盐酸的小烧杯中