2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是:( )
2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1 ②
H2(g)+1/2O2(g)=H2O(g) ΔH=-c kJ·mol-1 ③
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
C(金刚石,s) +O2(g)=CO2(g) ΔH1 ①
C(石墨,s) +O2(g)=CO2(g) ΔH2 ②
C(石墨,s)= C(金刚石,s) ΔH3=+1.9kJ·mol-1 ③
下列说法正确的是( )
2CO(g)+O2(g)=2CO2(g) △H1=-560kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-880kJ/mol
33.6L(标况)CO和CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为960kJ,求混合气体中CO和CH4的体积比为( )
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-27.6kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-58.8kJ/mol
Fe3O4(s)+CO(g)=3FeO(s) +CO2(g) △H3=+38.4kJ/mol
求以下热化学方程式的焓变
FeO(s)+CO(g)=Fe(s)+CO2(g) △H=。
P4(s)+10Cl2(g) =4PCl5(g) △H=bkJ·mol-1;
破坏PCl5中1molP-Cl键所需能量为ckJ,破坏PCl3中1molP-Cl键所需能量为1.2ckJ则破坏Cl2中1molCl-Cl键所需的能量为。
Ⅱ.已知拆开晶体硅中1molSi-Si键,二氧化硅固体中1molSi-O键,氧气中的1molO=O键分别需要提供a kJ、b kJ、c kJ能量,请写出晶体硅与氧气反应生成二氧化硅固体的热化学方程式: 。
CO(g)+H2O(g)=CO2(g)+H2(g)△H2。
则反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的△H=(用含△H1、△H2的代数式表示)
化学键 | H=H | O=O | O-H |
E/kJ·mol-1 | 436 | x | 463 |
已知:H2(g)+ O2(g)=H2O(g)△H=-241.8kJ·mol-1 , 则x=。
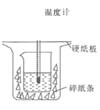
a.大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎纸条
b.用量筒量取盐酸时仰视刻度
c.NaOH溶液过量
d.将NaOH溶液分多次倒入盛有盐酸的小烧杯中
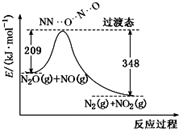
已知:N2(g)+2O2(g)=N2O4(g)△H=10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式为 。
|
化学键 |
H—H |
H—Cl |
|
键能 |
436 |
431 |
热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol-1 , 则Cl2的键能为kJ·mol-1。
H2(g)+1/2O2(g)=H2O(l) ΔH2=-bkJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-ckJ·mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的ΔH为kJ·mol-1(用含a,b,c的式子表示)。