(说明:以下溶液皆为稀溶液,在稀溶液中SO42﹣、Cl﹣呈无色.)
图一 请比较A,B,C,D,E五支试管中所盛试剂的颜色与所含微粒,进行分析.
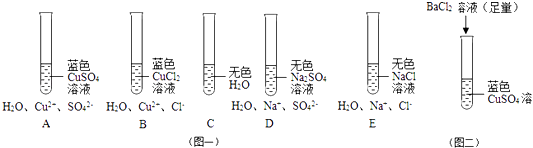
①对 A,B,C的分析是:A,B的溶液中均含Cu2+ , 均显蓝色,说明的存在使CuSO4、CuCl2溶液显蓝色.
②对 D,E分析,可以说明,在水溶液中,Na+是无色的.
对A,D的分析是:A,D的溶液中均含水分子、硫酸根离子,水分子不能使溶液显蓝色,在稀溶液中SO42﹣呈无色,A,D的溶液中均含水分子、硫酸根离子,水分子不能使溶液显蓝色,在稀溶液中SO42﹣呈说明A中是Cu2+使CuSO4溶液显蓝色.对B,E分析同理.
对A,B,C,D,E 还可推理:水是无色液体,作为溶剂,溶解CuSO4、CuCl2等物质时,溶液的颜色主要受溶质的影响.
如图二所示的方法是保持溶液中的Cu2+ . 该反应的化学方程式为:
请选择一种试剂与CuSO4溶液反应,除去溶液中Cu2+ 的存在.其化学方程式是:
上述研究方法是用不同的思维方式,从不同的切入点研究同一个问题,但总体思路仍然是对比实验设计的一般思路.