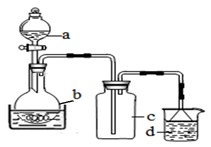
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、、,用浓硝酸洗涤、干燥。
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是。
②用5mL 溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
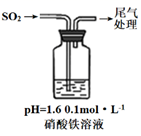
i.缓慢通入SO2 , 溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2 , 溶液逐渐变为深棕色。
已知:Fe2++NO⇌[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:。
⑤步骤ii后期反应的离子方程式是。