 京张高铁的复兴号火车“龙凤呈祥”内装使用材料FRP
B .
京张高铁的复兴号火车“龙凤呈祥”内装使用材料FRP
B .  中国馆屋顶ETFE保温内膜
C .
中国馆屋顶ETFE保温内膜
C .  八达岭长城城砖
D .
八达岭长城城砖
D .  2022年冬奥会高山滑雪服
2022年冬奥会高山滑雪服

| 甲 | 乙 | 丙 | |
| A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
| B | NH3 | NO | HNO3 |
| C | AlCl3 | Al(OH)3 | Al2O3 |
| D | Cl2 | HCl | CuCl2 |


| 选项 | 实验目的 | 实验方案 |
| A | 除去苯中混有的苯酚 | 加入适量的溴水充分反应后过滤 |
| B | 检验Fe2+溶液中是否含有Fe3+ | 向待测液中滴加几滴铁氰化钾溶液 |
| C | 除去粗盐中含有Mg2+、Ca2+、SO42-的试剂加入顺序 | 向该溶液中先加入NaOH溶液、再加BaCl2溶液,最后加碳酸钠溶液 |
| D | 检验SO2中是否含有HCl | 将产生的气体通入HNO3酸化的AgNO3溶液中 |


该过程的热化学方程式是。

Ⅲ.模拟H2提纯工艺:将CO2和H2分离得到H2的过程如下:

依据图示信息回答:
吸收池中发生反应的离子方程式是。
反应过程中有黄色固体生成,写出反应的离子方程式。
|
实验 |
试剂及操作 |
3小时后Cu2+浸出率(%) |
|
一 |
加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 |
81.90 |
|
二 |
加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 |
92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是。


其反应机理如下:
①Cu2S(s)⇌2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O⇌4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2O⇌Cu(NH3)42++4H2O(快反应)
提高铜的浸出率的关键因素是 。

写出甲→乙反应的化学方程式 ;丙的结构简式是。
实验Ⅰ:制取并收集ClO2 , 装置如图所示:
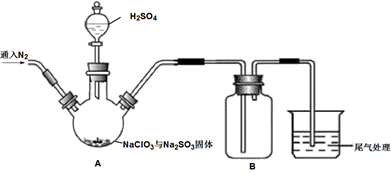
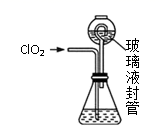
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L−1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I−+S4O62-)。
装置中玻璃液封管的作用是。
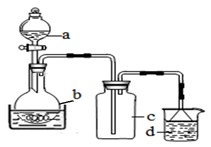
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、、,用浓硝酸洗涤、干燥。
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是。
②用5mL 溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
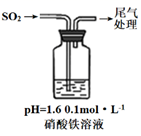
i.缓慢通入SO2 , 溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2 , 溶液逐渐变为深棕色。
已知:Fe2++NO⇌[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:。
⑤步骤ii后期反应的离子方程式是。