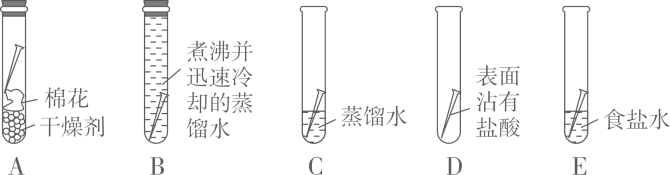
(知识回顾)用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
写出铁锈溶于盐酸的化学方程式:。
|
序号 |
实验I |
实验Ⅱ |
实验Ⅲ |
|
实验内容 |
|
|
|
|
现象 |
溶液颜色始终呈黄色 |
产生红褐色沉淀 |
溶液逐渐由黄色变浅绿色 |
①设计实验I的目的是。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是。
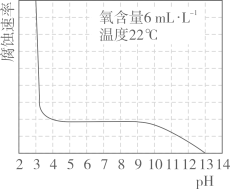
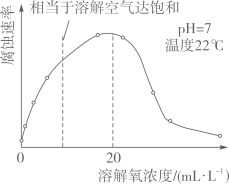
如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是。