H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图﹣1和图﹣2所示.
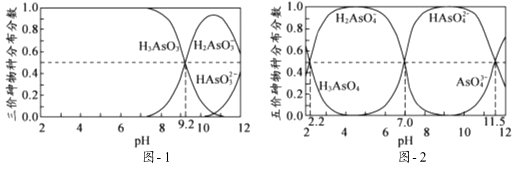
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加.该过程中主要反应的离子方程式为.
②H3AsO4第一步电离方程式H3AsO4⇌H2AsO4﹣+H+的电离常数为Ka1 , 则pKa1=
(p Ka1=﹣lg Ka1 ).
溶液的pH对吸附剂X表面所带电荷有影响.pH=7.1时,吸附剂X表面不带电荷; pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多.pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图﹣3所示.

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是.
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为. 提高吸附剂X对三价砷去除效果可采取的措施是.
微信扫码预览、分享更方便