【制取MgCO3•3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O的方法如图1:

MgCl2+CO2+2NaOH+2H2O═MgCO3•3H2O↓+2.
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2

表26﹣1 不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO3•3H2O |
47.95 | MgCO3•3H2O |
48.95 | MgCO3•3H2O |
49.95 | Mg5(OH)2(CO3)4•4H2O |
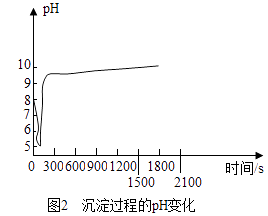
则沉淀过程选择的温度为,理由是.
利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3•3H2O的纯度.

依据实验过程回答下列问题:
实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有.
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡