|
金属离子 |
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
1.5 |
2.8 |
|
Fe2+ |
5.5 |
8.3 |
|
Al3+ |
3.0 |
4.7 |
制备流程如图:
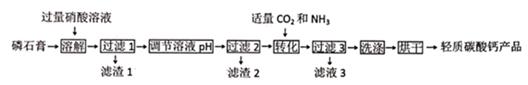
请问答:
用电子天平准确称量产品2.000g于干净的烧杯中,滴加2mol/L的盐酸恰好完全溶解,加蒸馏水继续蒸发除去过量的酸至pH=6~7,转移至250mL的容量瓶中,定容摇匀。用移液管准确移取25.00mL溶液于锥形瓶中,加入NaOH溶液10mL,摇匀,加入钙指示剂30mg,用已标定的EDTA(乙二胺四乙酸,可以表示为H4Y)标准溶液进行滴定。
已知:Ca2++Y4-=[CaY]2- , 测定数据如下:
|
待测产品溶液体积(mL) |
消耗EDTA标准溶液体积(mL) |
EDTA标准溶液的浓度(mol) |
|
|
1 |
25.00 |
14.90 |
0.1121 |
|
2 |
25.00 |
16.72 |
0.1121 |
|
3 |
25.00 |
15.00 |
0.1121 |
|
4 |
25.00 |
15.10 |
0.1121 |
①进行整个滴定操作实验的过程中,下列操作方法正确的是。
A.使用移液管移取溶液的时候,移液管尖嘴不能接触容器壁
B.滴定管水洗后,需要用标准溶液润洗3次,再排出气泡,使液面位于“0”刻度或“0”刻度以下
C.滴定管调液面后,需静置1~2min,再进行读取刻度数据进行记录
D.电子天平读数时,两边侧面应同时处于打开状态,使空气保持流通
②该产品中钙元素的质量分数为(保留两位有效数字),若滴定结束时仰视读数,则测定的结果(填“偏大”、“偏小”或“无影响”)。