 B .
B .  C .
C .  D .
D . 
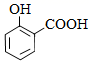 +2HCO3-→
+2HCO3-→ 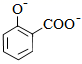 +2H2O+2CO2↑
D . 向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
+2H2O+2CO2↑
D . 向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是( )
反应Ⅰ:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) 慢反应 ΔH1
反应Ⅱ:H2O2(aq)+IO-(aq)→H2O(l)+O2(g)+I-(aq) 快反应 ΔH2
下列有关该反应的说法正确的是( )
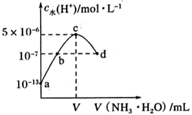
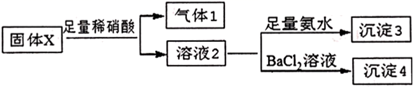
根据上述实验,固体粉末 的组合错误的是( )
由此推断出化合物M中x:y为。写出简要计算过程:。
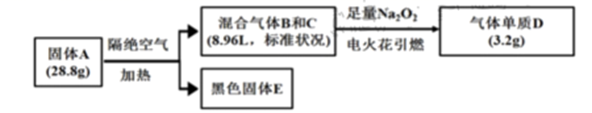
已知:①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。相同情况下气体B的密度大气体C。
③黑色固体 溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
请问答:

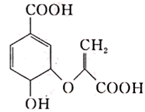
已知:a.-NH2 -NHCOCH3;
b.-CH(COOH)2 -CH2COOH+CO2;
请问答:
①是苯环上有二种氢,不能使FeCl3显色,IR谱表明分中无N-O键
②1mol该物质与足量Na发生反应放出1molH2(不考虑同一个碳上连2个-OH)
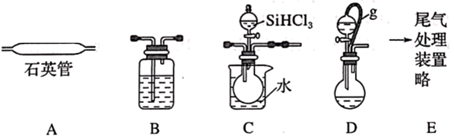
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:

在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
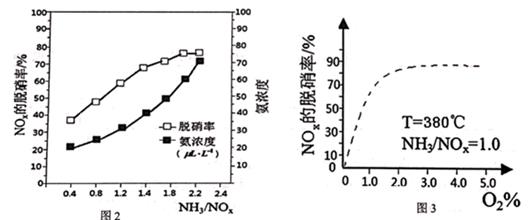 ①图2中,最佳氨氮比为2.0,理由是 。
①图2中,最佳氨氮比为2.0,理由是 。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示。
|
金属离子 |
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
1.5 |
2.8 |
|
Fe2+ |
5.5 |
8.3 |
|
Al3+ |
3.0 |
4.7 |
制备流程如图:
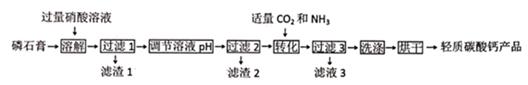
请问答:
用电子天平准确称量产品2.000g于干净的烧杯中,滴加2mol/L的盐酸恰好完全溶解,加蒸馏水继续蒸发除去过量的酸至pH=6~7,转移至250mL的容量瓶中,定容摇匀。用移液管准确移取25.00mL溶液于锥形瓶中,加入NaOH溶液10mL,摇匀,加入钙指示剂30mg,用已标定的EDTA(乙二胺四乙酸,可以表示为H4Y)标准溶液进行滴定。
已知:Ca2++Y4-=[CaY]2- , 测定数据如下:
|
待测产品溶液体积(mL) |
消耗EDTA标准溶液体积(mL) |
EDTA标准溶液的浓度(mol) |
|
|
1 |
25.00 |
14.90 |
0.1121 |
|
2 |
25.00 |
16.72 |
0.1121 |
|
3 |
25.00 |
15.00 |
0.1121 |
|
4 |
25.00 |
15.10 |
0.1121 |
①进行整个滴定操作实验的过程中,下列操作方法正确的是。
A.使用移液管移取溶液的时候,移液管尖嘴不能接触容器壁
B.滴定管水洗后,需要用标准溶液润洗3次,再排出气泡,使液面位于“0”刻度或“0”刻度以下
C.滴定管调液面后,需静置1~2min,再进行读取刻度数据进行记录
D.电子天平读数时,两边侧面应同时处于打开状态,使空气保持流通
②该产品中钙元素的质量分数为(保留两位有效数字),若滴定结束时仰视读数,则测定的结果(填“偏大”、“偏小”或“无影响”)。