实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10mol•L﹣1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10mol•L﹣1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10mol•L﹣1 Fe2(SO4)3溶液,再加入少量0.0005mol•L﹣1 Ag2SO4溶液 | 98.0 |
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是.
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L﹣1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中,证明发生反应 i.
b.取少量Ag2S粉末,加入溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
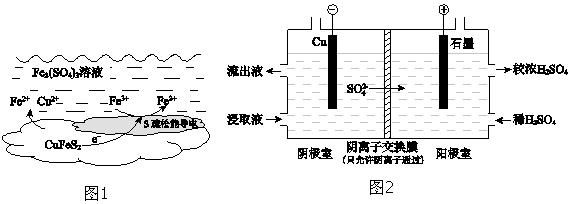
①电解初期,阴极没有铜析出.用电极反应式解释原因是.
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是.