1.
(2017高二下·萍乡期末)
常温下,HNO2的电离平衡常数为K=4.6×10﹣4(已知  =2.14),向20mL0.01mol•L﹣1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
=2.14),向20mL0.01mol•L﹣1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
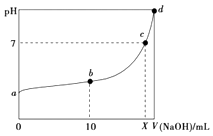
A . HNO2的电离方程式为HNO2=NO2﹣+H+
B . a点H2O电离出的c(H+)=2.14×10﹣3mol•L﹣1
C . b点溶液中离子浓度大小关系为c(NO2﹣)>c(Na+)>c(H+)>c(OH﹣)
D . X值等于20
