 C . 氯化钠的电离方程式:NaCl=Na++Cl﹣
D . 乙醇的结构式:C2H6O
C . 氯化钠的电离方程式:NaCl=Na++Cl﹣
D . 乙醇的结构式:C2H6O
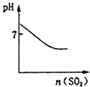 可表示将SO2气体通入溴水时pH的变化
B .
可表示将SO2气体通入溴水时pH的变化
B .  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .  表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .  表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线

| 共价键 | C﹣C | C=C | C﹣H | H﹣H |
| 键能/kJ•mol﹣1 | 348 | 610 | 413 | 436 |
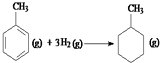 的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJ•mol﹣1=﹣384kJ•mol﹣1
D . 已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)•c(CO32﹣)=6.82×10﹣6
的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJ•mol﹣1=﹣384kJ•mol﹣1
D . 已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)•c(CO32﹣)=6.82×10﹣6
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;Ka•Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
常温常压,在 pH=5的稀醋酸溶液中,c(CH3COO‾)=;下列方法中,可以使0.10mol/LCH3COOH的电离程度增大的是.
a.加入少量0.10mol/L的稀盐酸b.加热CH3COOH溶液c.加入少量冰醋酸
d.加水稀释至0.010mol/L e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液.

c(H+)醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).
若b+c=14,则MOH为碱(填“强”或“弱”).
实验编号 | HA物质的量浓度 (mol•L﹣1) | NaOH物质的量浓度 (mol•L﹣1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka